Глюкоза
Глюко́за (від грец. γλυκύς — солодкий) (виноградний цукор, декстроза), С6Н12О6 — важливий моносахарид; безбарвні кристали солодкі на смак, легко розчиняються у воді.
| Глюкоза D-glucose | |
|---|---|
 | |
 | |
| Назва за IUPAC | (2R,3S,4R,5R)-2,3,4,5,6-Pentahydroxyhexanal |
| Інші назви | Виноградний цукор Blood sugar Dextrose Corn sugar D-Glucose Grape sugar |
| Ідентифікатори | |
| Абревіатури | Glc |
| Номер CAS | 50-99-7 |
| PubChem | 5793 |
| Номер EINECS | 200-075-1 |
| KEGG | C00031 |
| Назва MeSH | Glucose |
| ChEBI | 4167 |
| RTECS | LZ6600000 |
| Код ATC | V06DC01, B05CX01 і V04CA02 |
| SMILES |
OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O |
| InChI |
1/C12H24O12/c7-1-2-3(8)4(9)5(10)6(11)12-2/h2-11H,1H2/t2-,3-,4+,5-,6+/m1/s1 |
| Номер Бельштейна | 1281604 |
| Номер Гмеліна | 83256 |
| 3DMet | B04623 |
| Властивості | |
| Молекулярна формула | C6H12O6 |
| Молярна маса | 180,16 г/моль |
| Молекулярна маса | 180,063388 |
| Густина | 1,54 г/см3 |
| Тпл | α-D-glucose: 146 °C β-D-glucose: 150 °C |
| Розчинність (вода) | 91 g/100 mL |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
−1271 кДж/моль[1] |
| Ст. ентальпія згоряння ΔcH |
−2805 кДж/моль |
| Ст. ентропія S |
209,2 Дж/(K·моль)[2] |
| Теплоємність, c |
218,6 Дж/(K·моль)[2] |
| Фармакологія | |
| Код ATC | B05 CX01 |
| Небезпеки | |
| MSDS | ICSC 0865 |
| Індекс ЄС | not listed |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Міститься в соку винограду, в багатьох фруктах, а також у крові тварин і людей.
Робота м'язів виконується головним чином за рахунок енергії, яка виділяється при окисненні глюкози.

Глюкоза отримується при гідролізі полісахаридів крохмалю і целюлози (під дією ферментів або мінеральних кислот). Погано розчиняється в органічних розчинниках. Не електроліт. Використовується як засіб посиленого харчування або як лікарська речовина при обробці тканини. Також препарати на основі глюкози використовуються у медицині при визначенні наявності та типу цукрового діабету в людини.
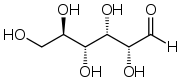
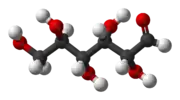
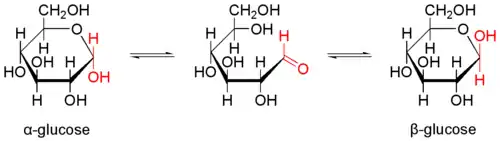
Природна кристалічна глюкоза (виноградний цукор) являє собою циклічну альфа-формулу. При розчиненні в воді вона переходить в ланцюгову, а через неї в бета-форму; при цьому установлюється динамічна рівновага між усіма формами.
Бета-форма також може бути виділена в кристалічному вигляді; у водному розчині вона утворює рівноважну систему з іншими формами.
Ланцюгова форма існує лише в розчинах, причому в дуже невеликій кількості, а в вільному вигляді не виділена.
Історія
Імовірно, глюкоза відома людині з давніх часів, оскільки вона кристалізується з меду. Однак в чистому вигляді її виділили набагато пізніше: німецький хімік Андреас Маргграф отримав її в 1747 році з виноградного соку, а Жозеф Луї Пруст в 1801 році вивів кристали α-D глюкози з нього. Завдяки цим експериментам за глюкозою закріпилася назва виноградного цукру.
Використання глюкози як підсолоджувача пов'язано з тим, що під час Наполеонівських воєн було заблоковане постачання тростинного цукру з Вест-Індії. Ще в 1000 році до н. е. в Китаї з крохмалю (способом ферментації рису) отримували штучний підсолоджувач — дисахарид мальтозу. До кінця XVIII ст. в Європі було відомо, що крохмаль можна обробити кислотою та отримати солодку речовину. Саме це дозволило К. С. Кірхгофу нагріванням картопляного крохмалю із сірчаною кислотою отримати солодкий сироп. У результаті оптимізації процесу він отримав сироп, який кристалізувався при настоюванні. Крім того, була зроблена спроба продавати одержувану масу у вигляді спресованого твердого продукту. Однак Наполеону організувати виробництво так не вдалося, так як постачання цукру було відновлене.
Процес отримання глюкози також досліджував французький хімік Соссюр. Він з'ясував, що крохмаль піддається гідролізу, при якому руйнуються зв'язки між вуглеводними фрагментами, причому на кожен розрив витрачається по одній молекулі води. Також було виявлено, що цукерки, вироблені з сиропів глюкози, не такі солодкі, як ті, що отримують з сахарози. Тому в Німеччині та інших країнах Європи було організовано виробництво глюкози.
У той час промислова глюкоза була недостатньо чистою та виходила у вигляді сиропів. Її доводилося багато разів кристалізувати з води, або використовувати органічні розчинники. Єдиною твердою формою, яку випускали у великій кількості, це була лита глюкоза (сироп заливали в форми, де він тверднув).
У 1923 році в США Вільям Б. Ньюкірк (англ. William B. Newkirk) запатентував промисловий спосіб отримання глюкози. Цей спосіб відрізнявся ретельним контролем умов кристалізації, завдяки чому глюкоза випадала з розчину у вигляді чистих, великих кристалів.
Хімічні властивості
Глюкоза може відновлюватися йодоводнем до 2-йодгексану[3]:
α-глюкоза взаємодіє з метанолом, утворюючи O-метил-α-глюкозу[3]. При цьому метильна група приєднується до атома оксигену з тієї гідроксильної групи, яка у ланцюговій формі є альдегідною.
При окисненні утворюється глюкуронова кислота. Вона також може бути і в циклічній, і в ланцюговій формі.
Відновлює гідроксид міді(II) до оксиду міді(I), а реактив Толленса до аміаку та срібла.
При взаємодії з гідроксиламіном утворює оксим, який під дією оцтового ангідриду перетворюється на ацильований гідроксинітрил. Останній під дією оксиду срібла та аміаку перетворюється на арабінозу:
Примітки
- Ponomarev, V. V.; Migarskaya, L. B. (1960). Heats of combustion of some amino-acids. Russ. J. Phys. Chem. (Engl. Transl.) 34: 1182–83.
- Boerio-Goates, Juliana (1991). Heat-capacity measurements and thermodynamic functions of crystalline α-D-glucose at temperatures from 10K to 340K. J. Chem. Thermodynam. 23 (5): 403–9. doi:10.1016/S0021-9614(05)80128-4.
- Ластухін, Воронов (2006). Органічна хімія. ISBN 966-7022-19-6.
