Карбонат натрію
Карбона́т на́трію Na2CO3, або кальцинована сода — безбарвна кристалічна речовина, добре розчиняється у воді. З водного розчину кристалізується у вигляді декагідрату Na2CO3 • 10H2O, який називають кристалічною содою. При прожарюванні вона втрачає кристалізаційну воду і перетворюється у безводну сіль Na2CO3, яка надходить у продаж під назвою кальцинованої соди. Кальцинована сода належить до найважливіших хімічних продуктів, має широке застосування в склоробній, миловарній, текстильній і паперовій промисловості, а також у паро-силовому господарстві для пом'якшення води і в домашньому побуті.
| Карбонат натрію | |
|---|---|
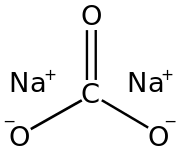 Структурна формула карбонату натрію | |
 Карбонат натрію | |
 | |
| Систематична назва | динатрій тріоксокарбонат |
| Інші назви | кальційована сода, вуглекислий натрій |
| Ідентифікатори | |
| Номер CAS | 497-19-8 |
| PubChem | 10340 |
| Номер EINECS | 207-838-8 |
| DrugBank | 09460 |
| ChEBI | 29377 |
| RTECS | VZ4050000 |
| SMILES |
[Na+].[Na+].[O-]C([O-])=O |
| InChI |
1/CH2O3.2Na/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 |
| Властивості | |
| Молярна маса | 105,99 г/моль |
| Молекулярна маса | 106 а.о.м. |
| Густина | 2,53 г/см³ |
| Тпл | 852 °C |
| Ткип | 1600 °C |
| Кислотність (pKa) | 10.33 |
| Основність (pKb) | 4.67 |
| Небезпеки | |
| ЛД50 | 4090 мг/кг (щури, орально) |
| Індекс ЄС | 011-005-00-2 |
| Класифікація ЄС | |
| R-фрази | R36/37 |
| S-фрази | S2, S22, S26 |
| NFPA 704 |
 0
1
1
|
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія промислового виробництва
Карбонат натрію Na2CO3, або сода, є одним з головних продуктів хімічної промисловості. У величезних кількостях сода споживається скляною, миловарною, целюлозно-паперовою, текстильною, нафтовою і іншими галузями промисловості, а також служить для отримання різних солей натрію. Застосування соди в домашньому вжитку загальновідомо.
До кінця XVIII століття вся сода, що застосовувалася в промисловості, добувалася виключно з природних джерел. Такими джерелами були природні відкладення карбонату натрію, що зустрічаються в Єгипті і деяких інших місцях, зола морських водоростей і рослин, що виростають на солончаковому ґрунті, і содові озера. У 1775 р. Французька академія наук, зважаючи на нестачу лугів у Франції, призначила премію за винахід якнайкращого способу отримання соди з куховарської солі. Проте пройшло шістнадцять років, перш ніж цим питанням зацікавився французький лікар Ніколя Леблан, який розробив економічно вигідний сульфатний спосіб отримання соди і в 1791 р. здійснив його у виробничому масштабі.
У 60-х роках XIX століття бельгійський хімік Ернест Сольве розробив новий «аміачний» спосіб отримання соди з хлористого натрію. Аміачний спосіб заснований на утворенні гідрокарбонату натрію при реакції між куховарською сіллю і гідрокарбонатом амонію в одному розчині. Цей спосіб повністю витіснив сульфатний спосіб Леблана. Головна його перевага перед сульфатним способом полягає в більшій економічності (малі витраті палива).
Використання
Карбонат натрію Na2CO3, або сода, є одним з головних продуктів хімічної промисловості. У великих кількостях сода споживається скляною, миловарною, целюлозно-паперовою, текстильною, нафтовою і іншими галузями промисловості, а також служить для отримання різних солей натрію. Загальновідоме застосування соди в домашньому вжитку.
Входить до складу суміші Ешка.
Виробництво в Україні
Основним виробником соди в Україні до 2009 року був Лисичанський содовий завод, який був монополістом у цій галузі. Однак після його банкрутства головним виробником стає Кримський содовий завод, власником якого є Group DF Дмитра Фірташа.
Див. також
Джерела
- Ф. А. Деркач «Хімія» Л. 1968
- В. І. Саранчук, М. О. Ільяшов, В. В. Ошовський, В. С. Білецький. Хімія і фізика горючих копалин. — Донецьк: Східний видавничий дім, 2008. — с. 600. ISBN 978-966-317-024-4