Металічний зв'язок
Металі́чний зв'язо́к — тип хімічного зв'язку, при якому валентні електрони атомів делокалізуються і починають взаємодіяти з атомними основами усього тіла.
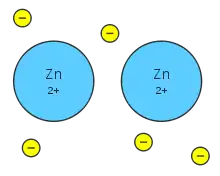
При встановленні металічного типу зв'язку з атомів утворюється метал, в якому позитивно заряджені іони занурені в електронний газ. Незважаючи на заряджений стан іонів, взаємодія між ними екранується рухливими електронами, й не поширюється на далекі відстані.
Наявність вільних електронів визначає всю сукупність властивостей речовин у металічному стані: високу електро- і теплопровідність; позитивний температурний коефіцієнт електроопору, здатність добре відбивати світлові хвилі (що зумовлює їхній характерний блиск і непрозорість), високу пластичність (ковкість), термоелектронну емісію, явище фотоефекту, магнітні властивості та ін.
На відміну від ковалентних і іонних сполук у металах невелике число електронів одночасно зв'язує велике число атомних ядер. Успільненням валентних електронів металічний зв'язок дещо нагадує ковалентний. Проте у металів спільні електрони не належать окремим парам атомів, вони повністю делокалізовані. Цим пояснюється відсутність просторової напрямленості та насичуваності металічного зв'язку. Делокалізація валентних електронів є наслідком багатоцентрового характеру металічного зв'язку й причиною високої електро- та теплопровідності металів.
Отже, металічний зв'язок є багатоцентровим хімічним зв'язком з дефіцитом електронів і базується на узагальненні зовнішніх електронів атомів. Тому він характерний лише для конденсованого стану речовини. У газуватому стані атоми всіх речовин, у тому числі й металів, зв'язані між собою тільки ковалентним зв'язком.
Більшість металів утворює одну з наступних високосиметричних ґраток зі щільною упаковкою атомів: кубічну об'ємно центровану, кубічну гранецентровану і гексагональну. У кубічній об'ємно центрованій ґратці атоми розташовані у вершинах куба і один атом в центрі обсягу куба. Кубічну об'ємно центровану ґратку мають метали: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba та інші. У кубічній гранецентрованій ґратці атоми розташовані у вершинах куба і в центрі кожної грані. Ґратки такого типу мають метали: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co та інші. У гексагональній ґратці атоми розташовані у вершинах і центрі шестигранних основ призми, а три атоми - у середній площині призми. Таку упаковку атомів мають метали: : Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca та інші. Вільно рухомі електрони зумовлюють високу електро- і теплопровідність. Речовини, для яких властивий металічний зв'язок, часто поєднують міцність з пластичністю, тому що при зміщенні атомів один щодо одного не відбувається розриву зв'язків.
Джерела
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім.. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- УГАТУ. Теория по химии для ВУЗов.