Морфолін
Морфолін — гетероциклічна сполука (тетрагідрооксазин-1,4). Хімічна формула HN(CH2CH2)2O. Використовує в органічному синтезі як каталізатор у якості основи (акцептор протона), зокрема, для отримання гемінальних дітіолов. Молекула має конформацію «крісла».
| Морфолін | |
|---|---|
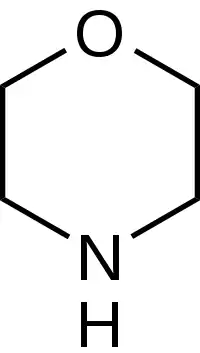 Скелетна структура | |
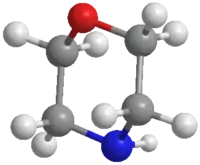 Просторова будова | |
| Назва за IUPAC | Морфолін |
| Властивості | |
| Молекулярна формула | C4H9NO |
| Молярна маса | 87,122 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Запах | аміачний |
| Тпл | -5 °C |
| Ткип | 128,3 °C |
| Розчинність (вода) | змішується |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Являє собою безбарвну, рухливу, гігроскопічну рідину з характерним сильним аміачноподібним запахом з температурою кипіння 128,3 °C. Морфолін розчинний у воді, спирті, етиленгліколь, бензолі, різних маслах, скипидарі та є прекрасним розчинників для великої кількості органічних речовин, включаючи смоли, барвники, віск, шелак і казеїни. Водні розчини морфоліну володіють цікавою властивістю - при їх кипінні pH середовища не змінюється.
Хімічні властивості
Хімічно морфолін є аміноефір. Ефірне угруповання в морфоліні інертна, тому реакції, у які вступає морфолін, у більшості своєму йдуть по атому азоту. Багато реакцій аналогічні вторинним амінам, хоч і є певна різниця азоту морфоліну від азоту вторинного аміну. У морфолін атом оксигену відтягує на себе електронну щільність від атома азоту і через це він стає менш нуклеофільним і менш основним, ніж в схожих за структурою амінах, наприклад таких як піперидин[1].
Отримання
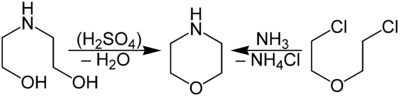
Уперше морфолин був отриманий німецьким вченим Людвігом Кнорре в 1889 р. при дегідратації діетаноламіну під дією 70%-ї сірчаної кислоти[2]. Як виявилося, що так само можна використовувати концентровану сірчану. Зараз ще морфолін отримують з β, β'-діхлоретілового ефіру й аміаку, при тиску вище 100 атм у присутності інертних розчинників.
Очищення
Для очищення його сушать над сірчанокислим кальцієм, після чого Обережно дистилюють. Рекомендують також перегонку або висушування над натрієм або висушування над KOH[3][4].
Застосування
Промисловість
Морфолин — інгібітор корозії, звичайна добавка, у мільйонних доляч, для регулювання pH як у системах на викопаному паливі, так і у системах ядернич реакторів. Використовує у якості абсорбента для очищення газів від CS2 і COS.
Органічний синтез
Морфолін широко використовується у органічнім синтезі. Наприклад, як будівельний блок для отриманні антибіотика линезолида і противоракового агента Gefitinib. Він також широко використовує для отримання єнамінів[5] .
Морфолін використовує у якості аміна у модифікації Киндлера реакції Вільгеродта для отримання ω-арилалканових кислот[6][7][8]. У дослідженнях і промисловості дешевизна й полярність морфоліна привела до його широкого застосування як розчинника для хімічних реакцій.
Безпека
Морфолін — легкозаймиста рідина з температурою спалаху 35 °C, температура самозаймання 230 °C. Пари дратують слизові оболонки дихальних шляхів, при потраплянні на шкіру викликають опіки. ЛД50 1,65 г/кг (миші й морські свинки, перорально); ГДК 0,5 мг/м3.[9][10]
Примітки
- Lindsay Smith, J. R.; McKeer, L. C.; Taylor, J. M. (1993), «4-Chlorination of Electron-Rich Benzenoid Compounds: 2,4-Dichloromethoxybenzene», Org. Synth.; Coll. Vol. 8: 167
- М. С. Малиновский. Окиси олефинов и их производные. М., Госхимиздат, 1961, стр. 253
- Гордон А., Форд Р. Спутник химика.//Перевод на русский язык Розенберга Е. Л., Коппель С. И. Москва: Мир, 1976. — 544 с.
- Perrin, D. D.; Armarego, W. L. F. Purification of Laboratory Chemicals, 3rd ed.; Pergamon: Oxford, 1988; p 233.
- Noyori, R.; Yokoyama, K.; Hayakawa, Y. (1988), «Cyclopentenones from α,α'-Dibromoketones and Enamines: 2,5-Dimethyl-3-Phenyl-2-Cyclopenten-1-one», Org. Synth.; Coll. Vol. 6: 520
- Кнунянц Л.И. Химическая энциклопедия, М. 1988, т.1, стр.366
- Newman, M. S.; Lowrie, H. S. Journal American Chemical Society 1954, 76, p. 6196.
- Mayer, R.; Wehl, J. AG(E) 1964, 3, 705.
- Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 6, М., 1960, с. 409-25
- Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 144. А. М. Карпейский.