Процес Біркеланда — Ейде
Процес Біркеланда — Ейде був одним з конкуруючих промислових процесів на початку виробництва азотних добрив.[1] Він був розроблений норвезьким промисловцем і вченим Крістіаном Біркеландом в 1903 році на основі методу використаного Генрі Кавендішем ще у 1784 р.[2] Насправді, на той час головною метою норвезького вченого було вивчення полярного сяйва. Щоб отримати гроші на проведення дослідження природного явища, Біркеланд придумав і розробив електромагнітний метод вилучення азотної кислоти з повітря. Разом зі своїм діловим партнером, інженером Семом Ейде, Крістіан створив першу установку, в якій атмосферне повітря під тиском проганяли через вольтову дугу змінного струму з напругою 5000 В та потужністю 500 кВт. Дуга оберталася в постійному магнітному полі, створюючи диск 2 м в діаметрі. Цей спосіб був використаний для фіксації атмосферного азоту (N2) в азотній кислоті (HNO3), одній з декількох хімічних процесів, які зазвичай називають фіксацією азоту. Отриману азотну кислоту потім використовували як джерело нітрату (NO3-) у реакції
- HNO3 → H+ + NO3−,
що може відбуватися в присутності води або іншого акцептора протона.[3]
Процес Біркеланда — Ейде відносно неефективний з точки зору енергоспоживання (<100 г HNO3 на 1 кВт·год).[3] Тому в 1910-х і 1920-х роках вона була поступово замінена в Норвегії поєднанням процесу Габера та процесу Оствальда. Процес Габера виробляє аміак (NH3) з молекулярного азоту (N2) та водню (H2). Аміак з процесу Габера потім перетворюється в азотну кислоту (HNO3) в процесі Оствальда.[4]
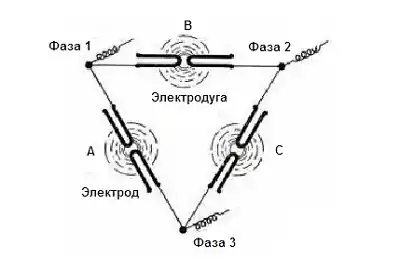
Процес
Електрична дуга була утворена між двома коаксіальними електродами, і за допомогою сильного магнітного поля була розподілена по тонкому диску. Температура плазми в диску перевищувала 3000 °C. За допомогою цієї дуги продувають повітря, що приводить до реакції долі азоту з киснем утворюючи оксид азоту. Ретельно контролюючи енергію дуги і швидкість повітряного потоку, отримували до 4 % окису азоту. Цей процес надзвичайно енергоємний. Крістіан Біркеланд використовував сусідню гідроелектростанцію для електроенергії, оскільки цей процес вимагав близько 15 МВт·год/т азотної кислоти. Така ж реакція здійснюється блискавкою, забезпечуючи природне джерело перетворення атмосферного азоту в розчинні нітрати.[5]
- N2 + O2 → 2NO
Гарячий оксид азоту охолоджується і поєднується з атмосферним киснем для отримання діоксиду азоту.
- 2NO + O2 → 2NO2
Цей діоксид азоту потім розчиняють у воді з утворенням азотної кислоти, яку потім очищають методом фракційної перегонки.[6]
- 3NO2 + H2O → 2HNO3 + NO
Примітки
- Remsen, I.; Renoup, H. (1906). "The Oxidation of Atmospheric Nitrogen with Reference to the Manufacture of Nitrates and Nitric Acid". American Chemical Journal. 35: 358–367. Retrieved 30 December 2015.
- Aaron John Ihde (1984). The development of modern chemistry. Courier Dover Publications. p. 678. ISBN 0-486-64235-6. ISBN 0-486-64235-6.
- Birkeland, Kr. (1906). "On the oxidation of atmospheric nitrogen in electric arcs". Transactions of the Faraday Society. 2 (December): 98.doi:10.1039/tf9060200098. ISSN 0014-7672.
- Trevor Illtyd Williams; Thomas Kingston Derry (1982). A short history of twentieth-century technology c. 1900-c. 1950. Oxford University Press. pp. 134–135. ISBN 0-19-858159-9. ISBN 0-19-858159-9.
- Karl Fisher; William E. Newton (2002). G. J. Leigh, ed. Nitrogen fixation at the millennium. Elsevier. pp. 2–3. ISBN 0-444-50965-8. ISBN 0-444-50965-8.
- Douglas Erwin (2002). Industrial Chemical Process Design. McGraw-Hill. p. 613. ISBN 0-07-137621-6. ISBN 0-07-137621-6.