Золь-гель
Золь-гель метод — приготування розчину прекурсору, переведення його у золь, потім у гель за рахунок гідролізу та конденсації, старіння, висушування й термоорбробка оксидного продукту.
Часто золь-гель метод включає у себе формування металооксіполімерних лагцюгів — золю або гелю з розчинних полігідрооксікомплексів, утворених внаслідок гідролізу металорганічних комплексних або неорганічних сполук. Оксиди, які утворюються, є високоактивними. Їхня дегідратація відбувається за низьких температур, іноді безпосередньо у гідролізі, супроводжується кристалічних оксидів з малим розміром частинок ( нм) та високорозвиненою поверхнею. При утворенні золів розподіл наночастинок за розмірами визначається тривалістю утворення зародків. Розмір нанокристалів зростає із збільшенням тривалості реакції й підвищенням температури (швидкість росту зародків).
Історія
Розвиток золь-гель технології почався з роботи Т.Грема, який вперше сформулював термін і поняття «колоїди». Грем відзначив клеєподібну поведінку розчинів деяких речовин, які назвав колоїдними. До колоїдних розчинів (золей) відносяться мікрогетерогенні системи, основними властивостями яких є наявність колоїдних частинок як окремої дисперсної фази, які представляють собою агрегати молекул. В колоїдних розчинах дисперсна фаза знаходиться в межах 1-100 нм, тому можна знехтувати гравітаційними силами. Таким чином, колоїдні розчини займають проміжне місце між грубодисперсними системами й істинними розчинами, є досить стійкими, оскільки частинких розчинених у них речовин довгий час не осідають під дією сил тяжіння. У цьому випадку головну роль відіграють ван-дер-ваальсові сили та сила відштовхування між поверхневими зарядами[1].
Загальна характеристика
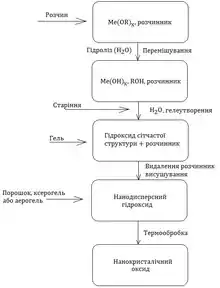
Для цілеспрямованого отримання наносистем золь-гель методом потрібне знання механізмів гідролізу та поліконденсації. Синтез оксидів металів часто супроводжується труднощами, наприклад, швидкості гідролізу алкоксидів або неорганічних солей, які використовуються за синтезу, можуть виявитися надто високими, що призводить до мікронеоднорідностей системи. А неповний перебіг гідролізу негативно впливає на хімічну й механічну стабільність наноструктур й зміну цих параметрів у процесі експлуатації матеріалу.
Універсальними прекурсорами є алкоголяти металів. Ці сполуки є дуже реакційноздатними по відношенню до нуклеофільних частинок, наприклад, молекул води.
Популярність класичного варіанту золь-гель методу обумовлена тим, що отримувані матеріали мають унікальні властивості. Серед них висока хімічна однорідність отриманих продуктів, яка дозволяє знизити температуру й тривалість термообробки для отримання функціональної кераміки, можливість контролювати розмір частинок та структуру пор матеріалів на різих стадіях процесу. З його допомогою можна отримувати нові види скла, органо-неорганічні гібридні сполуки, кераміку, волокна, плівки і композити (нанесенням золя на підставку або просочування пористого матеріалу). Також золь-гель метод застосовують для отримання пористих матеріалів, які застосовують як сорбенти, каталізатори або носії каталізатороів.
Цей метод є легким щодо його застосування, однак має недоліки: не забезпечує монодисперсність частинок; на відміну від синтезу у нанореакторах, не дозволяє отримувати двохвимірні або одновимірні структури й контролювати параметри анізотропії; цим методом не можна синтезувати просторово-впорядковані структури, які складаються з наночастинок, розташованих на однакових відстанях одна від одної (або паралельних пластинок із прошарком інтертної матриці).
Отримання нанострижнів рутильного діоксиду титану довжиною 15-30 нм і діаметром менше 10 нм змішується із у молярній пропорції 0,01 — 0,1. До суміші додають водний розчин аміаку. Продукт, який випав у осад, відмиваєтьсяд від йонів хлору та змішується із пероксидом водню у пропорції Отримана дисперсія розбавляється водою до концентрації 0,18M і витримується за температури протягом 4—12 годин. Інкорпорація йонів до ґратки ініціює утворення фази .
Серед одержання з метою зменшення розміру наночастинок використовують неводні реагенти. Ці способи базуються на взаємодії галогенідів титану (де — атоми фтору, хлору, брому або йоду) з кисенвмісними органічними речовинами, наприклад, ефірами ( — органічна група)[2].
Примітки
- В.С.Бушкова, Б.К.Остафійчук, О.В.Копаєв - особливості синтезу складних оксидних систем із використанням ЗГА методу.
- І.Ф.Миронюк, В.Л.Челядин - Методи одержання діоксиду титану (огляд).
