Пі-спіраль
Пі-спіраль (або π-спіраль) — вид вторинної структури, що інколи утворюється в білках.
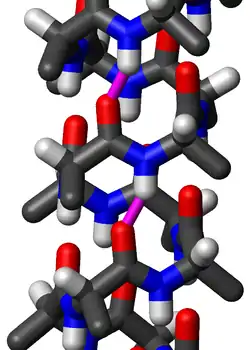
Звичайна структура
Амінокислоти в звичайній π-спіралі влаштовуються в правосторонній спіральній структурі. Кожна амінокислота відповідає повороту спіралі на 87° (тобто, спіраль має 4,1 залишків на виток), і має довжину 1,15 Å (=0,115 нм) уздовж осі спіралі. Важливою особливістю структури є те, що аміногрупа однієї амінокислоти формує водневий зв'язок з C=O групою амінокислоти на п'ять залишків раніше, ці повторні i+5→i водневі зв'язки визначають π-спіраль. Подібні структури включають 310-спіраль (i+3→i водневий зв'язок) і α-спіраль (i+4→i водневий зв'язок).
Залишки в π-спіралях зазвичай прийміть (φ, ψ) двогранний кут (-55°, -70°). Більш загалом, вони приймають двогранні кути таким чином що кут ψ одного залишку і кут φ наступного мають суму приблизно −125°. Для порівняння, сума відповідних кутів для 310-спіралі становить близько −75°, тоді як для α-спіралі становить близько 105°. Загальна формула для куту обертання Ω на залишок будь-якої поліпептидної спіралі з трансізомерами задається рівнянням:
Лівозакручена структура
В принципі, можлива лівозакручена версія π-спіралі, змінюючи знак двогранного куту (φ, ψ) на (55°, 70°). Ця псевдо-"дзеркальна" спіраль має приблизно те ж число залишків на оборот (4,1) і крок спіралі 1,5 Å. Проте ця структура не є дійсним дзеркальним відображенням, тому що амінокислотні залишки все ще мають ліву хіральність. Довга лівозакручена π-спіраль навряд чи спостерігається в білках, тому що серед природних амінокислот тільки гліцин здатний приймати позитивний кут φ.
Посилання
- Pauling L, Corey RB and Branson HR. (1951) «The Structure of Proteins: Two Hydrogen-Bonded Helical Configurations of the Polypeptide Chain», Proc. Nat. Acad. Sci. Wash., 37, 205.