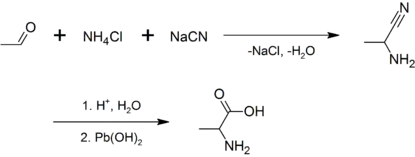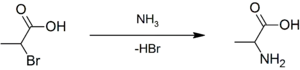Аланін
Алані́н — хімічна сполука природного походження, замінна амінокислота, що є важливим джерелом енергії для різних органів, зміцнює імунну систему шляхом участі в обміні цукрів та органічних кислот.[1] L-ізомер цієї кислоти входить до складу білків.
| Аланін | |
|---|---|
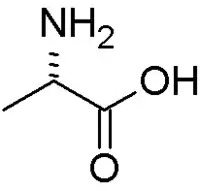 | |
| Систематична назва | (S)-2-Амінопропанова кислота |
| Ідентифікатори | |
| Абревіатури | A, Ala |
| Номер CAS | (D), 56-41-7 (L) 338-69-2 (D), 56-41-7 (L) |
| Номер EINECS | 200-273-8 |
| DrugBank | 00160 |
| KEGG | D00012 і C00041 |
| ChEBI | 16977 |
| SMILES |
N[C@@]([H])(C)C(O)=O |
| InChI |
InChI=1S/C3H7NO2/c1-2(4)3(5)6/h2H,4H2,1H3,(H,5,6)/t2-/m0/s1 |
| Номер Бельштейна | 1720248 |
| Номер Гмеліна | 49628 |
| Властивості | |
| Молекулярна формула | C3H7NO2 |
| Молярна маса | 89,1 г/моль |
| Густина | 1,401 |
| Тпл | 297 °C |
| Кислотність (pKa) | 2,33; 9,71 |
| Ізоелектрична точка | 6,00 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Неполярна амінокислота. Аланін — друга (після лейцину) по розповсюдженості амінокислота, яка часто входить в спіральні фрагменти білків. Кодується чотирма кодонами (GCU, GCC, GCA та GCG). Найпростіша з оптично активних амінокислот.
Історія та етимологія
Аланін був уперше синезований 1850 року, коли Адольф Штрекер змішав етаналь та аміак із синильною кислотою[2][3][4]. Амінокислоту було названо німецькою Alanin, що походить від слова альдегіди, з інфіксом -an- для легшої вимови[5], німецьке закінчення -in, яке використовується в хімічних сполуках, аналогічне англійському -ine і українському -ін.
Структура
Аланін є альфітичною амінокислотою, тому що до бокового ланцюга приєднана метильна група (-CH3); аланін є найпростішою α-амінокислотою після гліцину. Метил є нереактивним і тому навряд чи бере безпосередню участь у функціонуванні білка[6]. Аланін є замінною амінокислотою, тобто він синтезується в організмі людини і його не потрібно отримувати з їжею. Аланін міститься в різних продуктах, але особливо його багато у м'ясі.
Джерела
Біосинтез
Аланін може бути синтезований із пірувату і амінокислот із розгалуженими боковими ланцюгами, таких як валін, лейцин та ізолейцин.
Аланін може бути вироблений відновлювальним амінуванням пірувату. Цей процес складається із двох кроків. На першому кроці α-кетоглутарат, аміак та НАД перетворюються за допомогою глутаматдегідрогеназа на глутамат, НАД+ і воду. На другому кроці аміногрупа новоутвореного глутамату переноситься на піруват за допомогою ферменту амінотрансферази, регенеруючи α-кетоглутарат і перетворюючи піруват на аланін. Кінцевий результат полягає в тому, що піруват і аміак перетворюються в аланін, витрачаючи один відновний еквівалент[7]. Оскільки реакції трансамінування легко оборотні, а піруват присутній у кожній клітині, аланін може легко утворюватися і, таким чином, має тісні зв'язки з метаболічними шляхами, такими як гліколіз, глюконеогенез і цикл трикарбонових кислот.
Хемосинтез
L-аланін виробляється промисловим шляхом за допомогою декарбоксилювання L-аспартату за допомогою дії аспартат-4-декарбоксилази. Шлях ферментації до L-аланіну ускладнений аланін-рацемазою[8].
Рацемічну суміш аланіну можна приготувати за допомогою конденсації етаналю із хлоридом амонію при наявності ціаніду натрію за допомогою реакції Штрекера[9] або за допомогою амонолізу 2-бромопропанової кислоти[10] .
Деградація
Аланін руйнується окисним дезамінуванням, зворотною реакцією до реакції відновного амінування, описаної вище, що каталізується тими ж ферментами. Напрямок процесу значною мірою контролюється відносною концентрацією субстратів і продуктів залучених реакцій[7].
Фізіологічні функції
Глюкозо-аланіновий цикл
У савців аланін грає ключові роль у глюкозо-аланіновому циклі між тканинами і печінкою. У м'язах та інших тканинах, які руйнують амінокислоти для палива, аміногрупи збираються у вигляді глутамату завдяки трансамінуванню. Глутамат потім може передати свою аміногрупу пірувату, продукту гліколізу у м'язах, під дією аланінамінотрансферази, утворюючи аланін і α-кетоглутарат. Аланін потрапляє у кров і транспортується в печінку. Реакція аланінамінотрансферази відбувається в зворотному порядку в печінці, де регенерований піруват використовується в глюконеогенезі, утворюючи глюкозу, яка повертається до м'язів через систему кровообігу. Глутамат у печінці потрапляє до мітохондрії і розщеплюється глутаматдегідрогеназою до α-кетоглутарата і амоній, який, у свою чергу, бере участь у циклі сечовини задля формування сечовини, яка виводиться через нирки[11].
Глюкозо-аланіновий цикл дозволяє пірувату та глутамату видалятися зі м'язів і безпечно транспортуватися до печінки. Опинившись там, піруват використовується для регенерації глюкози, після чого глюкоза повертається до м'язів щоби метаболізуватися для отримання енергії: це переміщує енергетичний тягар глюконеогенезу до печінки замість м'язів, а вся доступна АТФ у м'язах може бути спрямована на їх скорочення[11]. Це катаболічний шлях, який залежить від розпаду білка в м'язовій тканині. Неясно, чи зустрічається це в не ссавців і якою мірою[12][13].
Зв'язок із діабетом
Зміни в циклі аланіну, які підвищують рівень сироваткової аланінамінотрансферази, пов'язані з розвитком діабету ІІ типу[14].
Хімічні властивості
Аланін корисний в експериментах зі втратою функцій у зв'язку з фосфорилюванням. Деякі методи передбачають створення бібліотеки генів, кожен із яких має точкову мутацію в різній позиції в певній, цікавлячій нас, області, іноді навіть у кожній позиції в цілому гені: це називається «сканувальний мутагенез». Найпростіший метод і той, який був використаний найпершим, є так зване сканування аланіну, коли кожна позиція по черзі мутується в аланін[15].
Гідрування аланіну дає аміноспирт аланінол, який є корисним хіральним будівельним блоком.
Вільний радикал
Дезамінування молекули аланіну утворює вільний радикал CH3C•HCO2−. Дезамінування можна індукувати в твердому або рідкому аланіні опроміненням, що викликає гомолітичне розщеплення зв'язку карбон–нітроген[16].
Ця властивість аланіну використовується в дозиметричних вимірюваннях у радіотерапії. Коли звичайний аланін опромінюється, випромінювання призводить до того, що певні молекули аланіну стають вільними радикалами, і, оскільки ці радикали стабільні, вміст вільних радикалів пізніше можна виміряти за допомогою електронного парамагнітного резонансу, щоб з'ясувати, якій кількості випромінювання піддався аланін[17]. Це вважається біологічно значущим показником кількості радіаційного ураження, якого жива тканина зазнає при тому самому радіаційному впливі[17]. Плани радіотерапії можуть бути доставлені в тестовому режимі до гранул аланіну, які потім можна виміряти, щоб перевірити, чи призначена схема дози опромінення правильно доставлена системою лікування.
Реакції
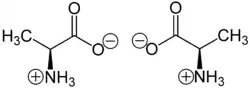
- взаємодія з основами:
- взаємодія з кислотами:
- взаємодія зі спиртами (реакція естерифікації):
- утворення пептидного зв'язку:
Примітки
- Алмакаева Л. Г. Аргинин и его применение в медицине и фармации / Л. Г. Алмакаева, Е. В. Литвинова // Ліки України плюс. — 2011. — № 1. — С. 23–26
- Adolph Strecker (1850). Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen [On the artificial formation of lactic acid and a new substance homologous to glycine]. Annalen der Chemie und Pharmacie (нім.) 75 (1): 27–45. doi:10.1002/jlac.18500750103. Штрекер згадує аланін на ст. 30.
- Adolph Strecker (1854). Ueber einen neuen aus Aldehyd – Ammoniak und Blausäure entstehenden Körper [On a new substance arising from acetaldehyde–ammonia [i.e., 1-aminoethanol] and hydrocyanic acid]. Annalen der Chemie und Pharmacie (нім.) 91 (3): 349–351. doi:10.1002/jlac.18540910309.
- Alanine. AminoAcidsGuide.com. 10 червня 2018. Процитовано 6 січня 2022.
- Alanine. Oxford Dictionaries. Процитовано 6 січня 2022.
- Patna B. K., Kara T. C., Ghosh S. N., Dalai A. K., ред. (2012). Textbook of Biotechnology (англ.). McGraw-Hill Education. ISBN 978-0-07-107007-2.
- Mathews C. K. , Van Holde K. E., Ahern K. G. (2000). Biochemistry (вид. 3rd). San Francisco, CA: Benjamin/Cummings Publishing. ISBN 978-0-8053-3066-3. OCLC 42290721.
- Drauz K., Grayson I. G., Kleemann A., Krimmer H. P., Leuchtenberger W., Weckbecker C. (2006). «Ullmann's Encyclopedia of Industrial Chemistry». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_057.pub2.
- dl-Alanine. Org. Synth. 9. 1929: 4. doi:10.15227/orgsyn.009.0004.; Coll. Vol. 1: 21..
- dl-Alanine. Org. Synth. 1941. doi:10.15227/orgsyn.009.0004.; Coll. Vol. 1: 21.
- Nelson, David L.; Cox, Michael M. (2005). Principles of Biochemistry (вид. 4-те). New York: W. H. Freeman. с. 684–85. ISBN 0-7167-4339-6..
- Fish Physiology: Nitrogen Excretion (англ.). Academic Press. 7 вересня 2001. с. 23. ISBN 978-0-08-049751-8.
- Walsh P. J., Wright P. A. (31 серпня 1995). Nitrogen Metabolism and Excretion (англ.). CRC Press. ISBN 978-0-8493-8411-0.
- Sattar N., Scherbakova O., Ford I., O'Reilly D. S., Stanley A., Forrest E., Macfarlane P. W., Packard C. J., Cobbe S. M., Shepherd J. (листопад 2004). Elevated Alanine Aminotransferase Predicts New-Onset Type 2 Diabetes Independently of Classical Risk Factors, Metabolic Syndrome, and C-Reactive Protein in the West of Scotland Coronary Prevention Study. Diabetes 53 (11): 2855–60. PMID 15504965. doi:10.2337/diabetes.53.11.2855.
- Park S. J., Cochran J. R. (25 вересня 2009). Protein Engineering and Design (англ.). CRC Press. ISBN 978-1-4200-7659-2.
- Zagórski Z. P., Sehested K. (1998). Transients and Stable Radical from the Deamination of α-Alanine. J. Radioanal. Nucl. Chem. 232 (1–2): 139–41. doi:10.1007/BF02383729..
- Andreo P., Burns D. T., Nahum A. E., Seuntjens J., Attix F. H. (2017). Alanine Dosimetry. Fundamentals of Ionizing Radiation Dosimetry (вид. 2-ге). Weinheim, Germany: Wiley-VCH. с. 547–556. ISBN 978-3-527-80823-6. OCLC 990023546.
Література
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.165-166)