Радіопротектори
Радіопротектори (РП) – це речовини або лікарські засоби, переважно синтетичного походження, введення яких перед опроміненням у середовище з біологічними об'єктами або в цілісний організм, знижує вражаючу дію іонізуючого опромінення в процесі його поглинання шляхом підвищення радіорезистентності або зниження радіочутливості та реалізують протипроменеві ефекти на фізико-хімічному і біохімічному рівнях.[1]
Механізми протипроменевої дії радіопротекторів[1]
За механізмом реалізації протипроменевого ефекту РП поділяють на індуктори гіпоксії та лікарські засоби (ЛЗ) з негіпоксичним механізмом дії.
До числа РП з гіпоксичним механізмом дії віднесено вазоактивні аміни, модулятори синтезу оксиду азоту (NO) та ЛЗ, які порушують в організмі транспорт кисню або його утилізацію клітинами. Проте останній клас препаратів, зокрема речовини, які викликають перетворення гемоглобіну на метгемоглобін або карбоксигемоглобін (амінопропіофенон, нітрит натрію, анілін, чадний газ та ін.), мають вкрай низький терапевтичний індекс та є доволі токсичними, тому на сьогоднішній день втратили свою клінічну значущість. В основі “кисневого посилення” (“кисневого ефекту”) пошкоджуючої дії ІО на організми лежать електроноакцепторні властивості кисню, завдяки яким він приєднується до радикалів дезоксирибонуклеїнової кислоти (ДНК), які утворюються під впливом прямої та опосередкованої дії радіації. При іонізації атомів на одній з ділянок макромолекули утворюється неспарений електрон, який й захоплюється О2 на свою орбіту. Таким чином О2 приєднується до молекули ДНК у місці розриву хімічного зв’язку, що призводить до зниження ефективності її репарації. Крім того внаслідок радіаційно-хімічних реакцій утворюються активні форми кисню (АФК): супероксиданіонрадикал (О2¯•), гідропероксидний радикал (НО2•), атомарний і синглетний кисень (О2´), збільшуючи число первинних пошкоджень макромолекул. Доведено, що реалізація “кисневого ефекту” на клітинному рівні залежить від напруги вільного кисню (ΔрО2) в тканинах організму та стану клітинної антиоксидантної системи (АОС: супероксиддисмутаза (СОД), Fe2+ цитохрому С, каталаза, глутатіонпероксидаза (GSH-пероксидаза), церулоплазмін, трансферин та ін.), адже утворення активних форм кисню постійно відбувається в клітині за фізіологічних умов та є результатом неповного одноелектронного (утворення О2•¯), двохелектронного (утворення Н2О2) або трьохектронного (утворення НО•) відновлення О2 замість його повного чотирьохелектрогнного відновлення з утворенням Н2О, але вказані реакції нівелюються функціональноспроможною АОС.[1]
Вміст кисню в клітинах в свою чергу визначається рівнем васкуляризації і станом мікроциркуляції в тканинах, швидкістю місцевого кровотоку, проникністю клітинних мембран для кисню та його розчинність в субклітинних структурах клітини, а також від інтенсивності споживання кисню клітинами.
Більш складним за характером рецепції є механізм радіозахисного ефекту амінів (індоліл-, фенілалкіламіни, катехоламіни, імідазоліни), які діють через систему спеціалізованих рецепторів – серотонінових, адреналових, гістамінових та ін., чим викликають вазоконстрикцію та відповідно циркуляторну гіпоксію. Крім стінок судин зазначені рецептори наявні на мембранах клітин і їх активація супроводжується передачею сигналу на підвищення радіорезистентності безпосередньо клітині.
Біогенні аміни характеризуються короткотривалою дією (20-30 хв.). Основними представниками підгрупи алкіламінів є нейромедіатор серотонін (серотоніну адипінат та гіпоксант мексамін (0,05-0,1 per os за 30-40 хв. перед опроміненням). Обидва є похідними триптаміну та виступають попередниками в синтезі мелатоніну.
З похідних імідазолів застосовуються адреноміметики індралін (препарат Б-190; 0,45 per os за 10-15 хв. перед опроміненням, тривалість дії – до 60 хв. та нафтизин (0,1% – 1,0 мл внутрішньом’язово за 3-5 хв. перед опроміненням). Крім того в якості радіопротекторів з гіпоксичним механізмом дії можуть застосовуватись адреноміметики мезатон та клонідин.
Останнім класом РП-індукторів гіпоксії є інгібітори NO-синтаз (NОS). Індукована ІО гіперпродукція АФК формує розвиток оксидативного стресу, одним із різновидів якого є нітрозативний стрес. Його розвиток обумовлений дисбалансом системи NО. Як відомо NО утворюється із L-аргініну за участі ферменту NОS, причому, якщо в “клітинах-мішенях” існує дефіцит її субстрату – L-аргініну, відбувається паралельне утворення супероксид та гідроксил-радикалів. При взаємодії супероксид-радикалу та NО утворюється більш агресивна молекула – пероксинітрит (ОNОО–), яка викликає пошкодження біомолекул. За своєю природою і властивостями NОS неоднорідна і можна виділити її 3 окремі підтипи. Зокрема, нейрональна (nNOS, NOS1), яка знаходиться переважно в структурах центральної і периферичної нервової системи, експресується постійно в нормі, а також бере участь у формуванні рефлекторних вазомоторних реакцій, які регулюють взаємозв’язок між функцією серця та тонусом артеріальних судин великого кола кровообігу. Ендотеліальна (eNOS, NOS3) була вперше ідентифікована в клітинах ендотелію кровоносних судин. Вона бере участь в утворенні ендотелій-релаксуючого фактору та безпосередньо впливає на тонус артеріол. Індуцибельна (іNOS, NOS2) експресується в клітинах ендотелію і макрофагах тільки при патологічних процесах, насамперед при запаленні та бере участь у синтезі прозапальних цитокінів – фактора некрозу пухлини, інтерлейкіну та ін.
Участь NO в регуляції судинного тонусу і периферичної гемодинаміки, дозволяє розглядати модифікацію ендогенного синтезу NO фармакологічними засобами як один з підходів для зміни радіочутливості біологічних тканин. Підвищення тонусу судин за умов пригнічення синтезу NO створює передумови для розвитку циркуляторної гіпоксії, що є фактором стійкості до променевого впливу. Потенційною NOS-інгібуючою активністю володіють сполуки, які унеможливлюють зворотній захват субстрату (L-аргініну) в клітину, інактиватори кофакторів NOS, інгібітори експресії NOS, інактиватори NO, який утворився та сполуки, які унеможливлюють зв’язування L-аргініну з ферментами.
На сьогоднішній день ведеться активний пошук РП-інгібіторів NOS, що слугувало виявленню виразних радіопротекторних властивостей у діфетуру (диетилфосфат S-етилізотіуронію), S-алкіл-похідних ізотіосечовини, N-арил-S-алкіл-похідних, N-арілтіосечовини, біс-ізотіосечовини, N-ацил-S-алкіл-заміщені похідні ізотіосечовини (сполука Т1023) та ін. Проте варто відзначити, що питання індикації ефективності інгібіторів NO-синтаз досі залишається відкритим.
В той же час привертає увагу й той факт, що донори NO (молсидомін (сіднофарм, нітропрусид натрію та ін.) прийнятні до застосування в постпроменевому періоді, оскільки здатні потенціювати радіозахисні ефекти протипроменевих ЛЗ інших груп, зокрема за рахунок покращення їх біодистриб’юції.
До РП з негіпоксичним механізмом дії належать сірковмісні сполуки, антиоксиданти, імуномодулятори, стероїди, полісахариди, несірковмісні амінокислоти, деякі антибіотики, спирти та вітаміни.
Сірковмісні (тіолові, сульфгідрильні, меркаптанові) РП є найпершою групою протирадіаційних препаратів (ФЗД = 1,1-2,7), адже їх радіозахисні властивості відомі майже 80 років. В основі їх радіозахисних властивостей лежать: (1) перехоплення вільних радикалів, (2) міграція енергії або заряду з макромолекул на SH-з’єднаннях шляхом переходу протону від SH-сполук до радикалу макромолекул з подальшою хімічною репарацією її до вихідного стану та (3) утворенням сумісних дисульфідів (R1SSR2).
Провідним механізмом дії всіх сірковмісних РП є елімінація АФК, які утворюються під дією ІО. Сірковмісні сполуки (R-SH) здатні реагувати з кисневими радикалами або радикалами біомолекул (Х•) в якості донорів атому водню: “2R-SH +O2 → R1SSR2 +2H2O” або “2R-SH +2Х• → R1SSR2 +2ХН”. Припускається, що регенерація білків досягається за рахунок обміну тіолових дисульфідів (R1SSR2) з глутатіоном, що каталізується тіолтрансферазою з послідуючою участю глутатіонової окисно-відновної системи (глутатіонредуктаза та НАДН). Для подальшої реалізації радіозахисної дії глутатіону актуальною є гіпотеза донації водню радикалу ДНК в конкуренції з киснем. Пероксиди ДНК при взаємодії з донорами водню здатні перетворюватись на нестійкі гідроксипероксиди, які розпадаються на вільні радикали (НО• та R=O.).
Крім того важливим молекулярним механізмом активності тіолів є посилення зв’язку ядерного фактора каппа-Б (NFkB), протеїну-1γ (MIP-1γ) та онкосупресору р53 з молекулою ДНК, що викликає активацію деяких генів, зокрема, Mn-СOД та ін. Крім того, SH-сполуки здатні блокувати топоізомеразу II, а також при активації р53 через інгібітор циклінзалежних кіназ р21WAF-1 затримувати проходження клітин за клітинним циклом у фазі G1 та поліпшувати умови для репарації ДНК.
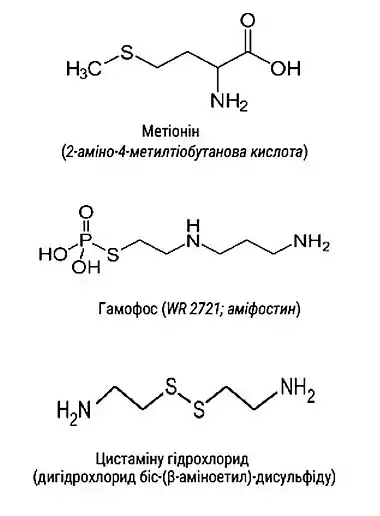
До числа найбільш важливих з точки зору практичного використання SH-РП відносяться сірковмісні амінокислоти (цистеїни та метіонін, похідні амінокислот (цистеамін та його дисульфід цистамін, таурин, ацетилцистеїн тощо) та інші SH-сполуки: гамафос (сполука WR-2721, в США – аміфостин, ізотіуронілу гідробромід та ін.
Найуживанішим сірковмісним РП є цистаміну гідрохлорид (0,2-0,8 per os за 10-30 хв. перед опроміненням, тривалість дії – до 5 год.) та комплексоутворюючий антидот з радіопротекторною дією унітіол (димеркаптрол; 5,0 % – з розрахунку 0,005 / 1 кг м. т., внутрішньом’язово/підшкірно за 10-30 хв. перед опроміненням), який застосовується переважно при отруєннях “тіоловими отрутами”.
Найгетерогеннішою групою РП з негіпоксичним механізмом дії виступають антиоксиданти (ФЗД = 1,1-1,3). До РП-антиоксидантів належать: ендогенні ферменти (СОД, каталаза, глутатіон-пероксидаза, трансферин, глутатіон-пероксидаза, церулоплазмін, меланін та ін.), синтетичні антиоксиданти (дибунол (іонол), мексидол (етилметилгідроксипіридину сукцинат та ін.), нітроксидвивільнюючі сполуки (темпол, ізосорбіду мононітрат, JP4-039 та ін.), поліфенольні сполуки рослинного походження (кверцетин та ін.) та фітоадаптогени (Gingko biloba, Centella asiatica, Hippophae rhamnoides, Ocimum sanctum, Panax ginseng, Podophyllum hexandrum, Amaranthus paniculatus, Emblica officinalis, Phyllanthus amarus, Piper longum, Tinospora cordifolia, Mentha arvensis, Mentha piperita, Syzygium cumini, Zingiber officinale, Ageratum conyzoides, Aegle marmelos, Aphanamixis polystachya та ін.) та деякі мікроелементи (селен, цинк та ін.).
Радіозахисний ефект всіх антиоксидантів обумовлений їх здатністю пригнічувати процеси вільнорадикального окислення та підвищувати активність антиоксидантних систем організму. Найбільшу увагу в якості РП-антиоксиданту звернуто до препаратів СОД (рекомбінантна СОД, CuZn-СОД), які продемонстрували свою ефективність як при введенні перед, так і одразу після опромінення. Крім того привертають увагу дані літератури про здатність деяких поліфенольних сполук рослинного походження (Vitis vinefera, Withaferin somnifera, axus bataccca, Azardiracta indica, Tinospora cordifolia) окрім радіопротективної активності за антиоксидантним механізмом, ще й проявляти цитотоксичну дію на ракові клітини та виступати радіосенсибілізаторами за променевого лікування.
Окрему увагу привертають радіопротекторні ефекти низькомолекулятрих фенольних сполук мелатонінів, як антиоксидантів з полівекторними властивостями. Відомо, що ІО, освітлення, радіовипромінювання та електромагнітні поля пригнічують продукцію ендогенного мелатоніну. Мелатонін є нейромедіатором (у гіпокампі), гормоном (блокує синтез і секрецію гіпофізом гонадотропінів), імуномодулятором (активізує імунну систему, знижує секрецію мелатоніну, викликає інволюцію тимусу), антиканцерогеном (гальмує проліферацію клітин), антиоксидантом, має рецептори на всіх клітинах (мембранні та ядерні), що в цілому гальмує старіння і підвищує адаптацію організму. Як антиоксидант мелатонін є ендогенним, виділяється переважно вночі, амфіфільний (водо- та жиророзчинний), активніший за токоферол і глутатіону.
Важливу роль в радіопротекції негіпоксичного механізму на сьогоднішній день відводять імуномодуляторам (ФЗД = 1,1-1,4). На сьогоднішній день в якості РП-імуномодуляторів в радіаційний терапії вивчаються цитокіни та їх індуктори (інтерлейкін (ІЛ)-1, ІЛ-2, ІЛ-3, ІЛ-6, ІЛ-7, ІЛ-11, ІЛ-12, гранулоцитарний колонієстимулюючий фактор (Г-КСФ), фактор стромальних клітин (SCF), фактор росту кератиноцитів та ін.), а також похідним пурину чи піримідину (ксантозин, кофеїн, метилурацил, пентоксил, теофілін та ін.).
Значна роль цитокінів в радіопротекції зумовлена перш за все їх здатністю до спрямованого впливу на систему гемопоезу, що сприяє відновленню скоординованої та врегульованої роботи клітин гемопоетичної системи, яка у відповідності до закону Бергоньє-Трибондо (клітини мітотичної (M) фази і кінця G2 фази клітинного циклу, як правило, найбільш чутливі до радіації в порівнянні з клітинами в ранні S і G1/G0 фази) виступає “органом-мішенню” за дії ІО.
Радіозахисні властивості притаманні також простагландинам (ПГ; Pg) і їх синтетичним аналогам та нестероїдним протизапальним засобам (НПЗЗ), проте вони володіють абсолютно різними механізмами їх реалізації. Так відомо, що НПЗЗ (целекоксиб, ацетилсаліцилова кислота та ін.) викликаючи перехід клітин до стану спокою (G0/G1 фази клітинного циклу), чим підвищують радіорезистентність тканин. Варто відзначити й цінні протиракові власті НПЗЗ: антипроліферативна дія, здатність пригнічувати неоангіогенез та активація церамідного шляху апоптозу, обумовлена збільшенням концентрації арахідонової кислоти. Проте системне застосування НПЗЗ значно обмежене їх побічними ефектами, зокрема ульцерогенною дією.
ПГ (мізопростол, алпростадил та ін.) не впливають на клітинний цикл жодним чином, проте вони здатні регулювати клітинний ріст та процеси диференціації шляхом інгібування прозапальних цитокінів, демонструючи при цьому свої не медіаторні, а імуномодулюючі властивості. ПГ проявляють радіозахисні властивості при введенні перед опроміненням (ФЗД<1,3), але їх використання значно обмежене численними побічними ефектами.
До радіопротекторів з негіпоксичним механізмом дії також відносять стероїди та їх синтетичні аналоги з естрогеноподібною активністю (β-естрадіол, діетилстільбестрол (РТД-77), 5-андростендіол та ін.), полісахариди (продігіозан, сальмозан, маннан, пірогенал, солі хітозану (РС-10, РС-11), хондроїтинсульфат, гепарин та ін.), несірковмісні амінокислоти (глутамінова, аспаргінова та ін.), похідні нуклеотидів і нуклеозидів (натрію нуклеїнат, фосфаден, рибоксин, інозин, гуанозин, аденозин та ін.), антибіотики фтохінолони та тетрацикліни, спирти (батиловий, етиловий та ін.) та вітаміни (аскорбінова кислота, піридоксину гідрохлорид, токоферолу ацетат, нікотинамід та ін.).
Також варто зазначити, що на сьогоднішній день ведеться активний багатовекторний пошук потенційних РП (наноалмази, гідратований фулерен, 2-меркаптобензотазол та ін.
Лікарські засоби і біологічно активні речовин, які проявляють радіопротекторні властивості
- ЛЗ з гіпоксичним механізмом дії (індуктори гіпоксії)
- Природні біогенні вазоактивні аміни (гістамін, ацетилхолін, адреналін, серотонін, триптамін та ін.)
- Синтетичні аналоги біогенних амінів
- Індоліл- та фенілалкіламіни (мексамін, серотоніну адипінат та ін.)
- Імідазоли та адреноміметики (мезатон, нафтизин, клонідин, індралін та ін.)
- Інгібітори нітроксидсинтаз (молсидомін, аміногуанідин та ін.)
- ЛЗ, що порушують в організмі транспорт кисню (метгемоглобін-, карбоксигемоглобінутворювачі) або його утилізацію клітинами (ціаніди, ціаногенні глікозиди, нітрит натрію, амінофеноли, анілін та ін.)
- ЛЗ з негіпоксичним механізмом дії
- Сірковмісні сполуки
- Сірковмісні амінокислоти (цистеїн та метіонін)
- Похідні сірковмісних амінокислот (цистаміну гідрохлорид, таурин, ацетилцистеїн та ін.)
- Сірковмісні сполуки інших груп (β-меркаптоетиламід, унітіол, β-еміноетил, ізотіуроніл гідробромід, цистофос, гамафос (аміфостин, γ-амінопропіламіноетилтіофосфат), похідні тіазолідону та ін.)
- Антиоксиданти
- Ендогенні ферменти (супероксиддисмутаза, каталаза, глутатіон-пероксидаза, трансферин, глутатіон-пероксидаза, церулопазмін, меланін та ін.)
- Синтетичні антиоксиданти (дибунол, мексидол та ін.)
- Нітроксидвивільнюючі сполуки (темпол, ізосорбін мононітрат, JP4-039 та ін.)
- Поліфенольні сполуки рослинного походження (кверцетин та ін.) та фітоадаптогени (екстракт елеутерококу, женьшеню, лимоннику китайського та ін.)
- Мікроелементи (селен, цинк та ін.)
- Імуномодулятори
- Ендогенні імуномодулятори
- Цитокіни та ростові фактори (ІЛ-1, ІЛ-2, ІЛ-3, ІЛ-6, ІЛ-7, ІЛ-11, ІЛ-12, гранулоцитарний колонієстимулюючий фактор (Г-КСФ), фактор стромальних клітин (SCF), фактор росту кератиноцитів та ін.)
- Імунорегулятроні пептиди органічного походження (тималін, тимоптин, тактивін, спленін, лієнін, гемалін, мієлопід, гепарин та ін.)
- Білки гострої фази (церулоплазмін, α1-кислий глікопротеїд та ін.)
- Екзогенні природні імуномодулятори
- Корпускулярні мікробні препарати (черевнотифозна вакцина з секстанатоксином, протейна вакцина, тетравакцина та ін. вакцини)
- Агоністи Toll-подібних рецепторів (CBLB502 та ін.)
- Екстракти, фракції та продукти життєдіяльності мікроорганізмів (біостим, статолон, рибомунал, леван, зимозан та ін.)
- Синтетичні імуномодулятори
- Похідні імідазолу (левамізол, дібазол та ін.)
- Похідні пурину чи піримідину (ксантозин, кофеїн, метилурацил, пентоксил, теофілін та ін.)
- Інгібітори синтезу простагландинів (інтерлок, реаферон, інтрон, нестероїдні протизапальні засоби)
- Ендогенні імуномодулятори
- Простагландини та їх синтетичні аналоги (ПГ Е2, ПГ І2, мізопростол та ін.)
- Стероїди та їх синтетичні аналоги з естрогеноподібною активністю (β-естрадіол, діетилстільбестрол (РТД-77), 5-андростендіол та ін.)
- Полісахариди
- Ліпополісахариди (продігіозан, сальмозан, маннан, пірогенал та ін.)
- Глюкани (солі хітозану (РС-10, РС-11), транслам та ін.)
- Глікани (хондроїтинсульфат, гепарин та ін.)
- Несірковмісні амінокислоти (глутамінова, аспаргінова та ін.) та похідні нуклеотидів і нуклеозидів (натрію нуклеїнат, фосфаден, рибоксин, інозин, гуанозин, аденозин та ін.)
- Антибіотики фтохінолони та тетрацикліни
- Спирти (батиловий, етиловий та ін.)
- Вітаміни (аскорбінова кислота, піридоксину гідрохлорид, токоферолу ацетат, нікотинамід та ін.)[1]
- Сірковмісні сполуки
Примітки
- Hladkykh, Fedir; Hladkykh, Fedir (31 грудня 2018). Pharmacoprophylactic and Pharmacotherapeutic Approaches to Mitigating the Damaging Effects of Ionizing Radiation: Review of Information Sources, Pharmacoprophylactic and Pharmacotherapeutic Approaches to Mitigating the Damaging Effects of Ionizing Radiation: Review of Information Sources. Path of Science, Path of Science 4, 4 (12, 12). ISSN 2413-9009. doi:10.22178/pos.41-5, 10.22178/pos.41-5. Процитовано 1 січня 2019.[недоступне посилання з листопадаа 2019]
Література
- Адаптогены и родственные группы лекарственных препаратов – 50 лет поисков / Е. П. Студенцов, С. М. Рамш, Н. Г. Казурова, О. В. Непорожнева, А. В. Гарабаджиу, Т. А. Кочина, М. Г. Воронков, В. А. Кузнецов, Д. В. Криворотов // Обзоры по клинической фармакологии и лекарственной терапии. – 2013. – Т. 11, № 4. – С. 3-43.
- Белоногов И. А. Токсикология и медицинская защита: учеб. пособие / И. А. Белоногов, Д. А. Самохин. Минск: Высшэйшая школа, 2014. – 412 с.
- Васильев Р. О. Радиопротекторные свойства и терапевтическая эффективность "Монклавит-1": автореф. дисс. ... канд. биол. наук: 03.01.01, 06.02.03 / Васильев Роман Олегович. – М., 2016. – 22 с.
- Васин М. В. Адреномиметики как компонент полирадиомодификации при лучевой терапии опухолей / М. В. Васин, Н. П. Ермакова, В. М. Кримкер // Медицинская радиология и радиационная безопасность. – 2011. – Т. 56, № 1. – С. 5-10.
- Васин М. В. Классификация противолучевых средств как отражение современного состояния и перспективы развития радиационной фармакологии / М. В. Васин // Радиационная биология. Радиоэкология. – 2013. – Т. 53, № 5. – С. 459-467.
- Васин М. В. Поиск и исследование новых эффективных средств фармакохимичесой защиты организма от поражающего действия ионизирующего излучения в ряду индолилалкиламинов. Дисс. докт. мед. наук. – М., 1977. – 510 с.
- Васин М. В. Противолучевые лекарственные средства. – М.: РМАПО, 2010. – 180 с.
- Васин М. В. Средства профилактики и лечения лучевых поражений. – М.: РМАПО, 2006. – 340 с.
- Вечканов Е. М. Основы радиационной биофизики: учебное пособие / Е. М. Вечканов, В. В. Внуков. – Ростов, 2009. – 48 с.
- Вивчення в експерименті потенційних радіопротекторів – S-(азагетерил) заміщених цистеаміну / Н. Є. Узленкова, О. А. Бражко, М. М. Корнет, В. М. Пасюга, Н. Г. Скоробогатова, І. О. Леонова, О. В. Ненюкова, О. Л. Масленнікова // Український радіологічний журнал. – 2014. – № 2 – С. 149-154.
- Владимиров В. Г. Радиопротекторы: структура и функция / В. Г. Владимиров, И. И. Красильников, О. В. Аронов. – Киев: Наукова думка, 1989. – 259 с.
- Владимиров В. Г. О некоторых итогах и перспективах развития профилактической радиационной фармакологии / В. Г. Владимиров, И. И. Красильников // Обзоры по клинической фармакологии и лекарственной терапии. – 2011. – Т. 9, № 1. – С. 44-50.
- Власенко Т. Н. Современные подходы к фармакологической профилактике радиационных поражений / Т. Н. Власенко, В. Б. Назаров, А. Н. Гребенюк // Биомедицинский журнал Medline.ru. Фармакология. – 2010. – Т. 11. – С. 230-253.
- Гладких Ф. В. Фармакопрофілактичні та фармакотерапевтичні підходи до послаблення пошкоджуючої дії іонізуючого опромінення: огляд інформаційних джерел / Ф. В. Гладких // Траєкторія науки: міжнародний електронний науковий журнал. – 2018. – Т. 4, № 12. – С. 5001-5022. – DOI: http://dx.doi.org/10.22178/pos.41-5.
- Гребенюк А. Н. Радиомигитаторы: перспективы использования в системе медицинской противорадиационной защиты / А. Н. Гребенюк, В. И. Легеза, Р. А. Тарумов // Военно-медицинский журнал. – 2014. – № 6. – С. 39-43.
- Гудков И. Н. Стратегия биологической противорадиационной защиты: радиопротекторы, радиолокаторы, радиодекторпоранты / И. Н. Гудков // Проблеми безпеки атомних електростанцій і Чорнобиля. – 2003. – Вип. 3, Ч. 1. – С. 133-140.
- Гудков С. В. Радиозащитные вещества: история, тенденции и перспективы / С. В. Гудков, Н. Р. Попова, В. И. Брусков // Биофизика. – 2015. – Т. 60, Вып. 4. – С. 801-811.
- Деримедвідь Л. В. Експериментальне дослідження протипроменевих властивостей рекомбінантної супероксиддисмутази / Л. В. Деримедвідь, Л. І. Симонова, В. З. Гертман // Український радіологічний журнал. – 2003. – № 11. – С. 432-437.
- До питання про механізми радіопротекторної дії наноалмазів / Є. М. Мамотюк, С. В. Руденко, В. А. Гусакова, І. О. Леонова, О. В. Ненюкова, О. Л. Масленнікова // Український радіологічний журнал. – 2009. – № 17. – С. 486-490.
- Дёмина С. А. Противолучевые средства: классификация и механизмы / Проблеми радіаційної медицини та радіобіології. – 2015. – № 20. – С. 42-54.
- Ефективність есміну при дії на організм іонізуючого випромінювання / Н. Є. Узлєнкова, Є. М. Мамотюк, Г. С. Григор’єва, Н. Ф. Конахович // Журнал НАМН України. – 2013. – Т. 19, № 1. – С. 34-45.
- Ильин Л. А. Противолучевые средства в системе радиационной защиты персонала и населения при радиационных авариях / Л. А. Ильин, И. Б. Ушаков, М. В. Васин // Медицинская радиология и радиационная безопасность. – 2012. – Т. 57, № 3. – С. 26-31.
- К вопросу о механизме радиозащитного действия ингибиторов NO-синтаз / М. В. Филимонова, Л. И. Шевченко, Т. П. Трофимова, В. М. Макарчук, А. С. Шевчук, Г. А. Лушникова // Радиационная биология. Радиоэкология. – 2014. – Т. 54, № 5. – С. 500–506.
- Макарчук В. М. Радиобиологические эффекты модификаторов эндогенного синтеза оксида азота: автореф. дисс. ... канд. биол. наук: 03.01.01 / Макарчук Виктория Михайловна. – Обнинск, 2015. – 18 с.
- Никишин С. А. Сравнительное исследование гемато- и миелопротекторной эффективности дикарбамина и лейкостима при лучевой супрессии гемопоэза: экспериментальное исследование: автореф. дисс. ... канд. мед. наук: 14.03.06 / Никишин Сергей Александрович. – Саранск, 2013. – 21 с.
- Некоторые морфоклинические доказательства радиопротективного характера мелатонинов (обзор литературы) / З. А. Воронцова, А. А. Иванов, Д. Б. Никитюк, В. А. Аванесова // Вестник новых медицинских технологий. Электронный журнал. – 2016. – № 4. – Публ. 8-2. – DOI: http://dx.doi.org/10.12737/22219.
- Практическое руководство по использованию медицинских средств противорадиационной защиты при чрезвычайных ситуациях и обеспечению ими аварийных медико-санитарных формирований и региональных аварийных центров / А. Н. Гребенюк, В. И. Легеза, В. Д. Гладких, А. А. Тимошевский, В. Б. Назаров. М.: Комментарий, 2015. – 304 с.
- Поздеев А. В. Разработка радиозащитных средств на основе веществ растительного и минерального происхождения: автореф. дисс. ... доктора биол. наук: 03.01.01 / Поздеев Александр Владимирович. – Кострома, 2015. – 45 с.
- Попова Н. Р. Природные пуриновые соединения как радиозащитные средства / Н. Р. Попова, С. В. Гудков, В. И. Брусков // Радиационная биология. Радиоэкология. – 2014. – Т. 54, № 1. – С. 38-49. – DOI: http://dx.doi.org/10.7868/S0869803117020126.
- Пономарцева Т. В. Фармакологическая защита пациентов при проведении медицинских рентгенологических исследований / Т. В. Пономарцева, С. А. Кальницкий А. В. Водоватов // Биотехносфера. – 2012. – № 3-4 (21-22). – С. 2-9.
- Проблеми використання радіозахисних препаратів: організаційні та наукові аспекти / Ю. М. Скалецький, В. Ф. Торбін, В. В. Вороненко, В. П. Печиборщ // Довкілля та здоров’я. – 2013. – № 1(64). – С. 30-33.
- Протипроменевий ефект низьких концентрацій розчину гідратованого фулерену в експериментах на щурах / Є. М. Мамотюк, О. В. Ненюкова, Г. В. Андрієвський, А. О. Тихомиров // Український радіологічний журнал. – 2009. – № 17. – С. 491-496.
- Радиозащитное действие биопрепаратов из мидий и рапаны / Л. И. Симонова, Л. П. Абрамова, С. Н. Пушкарь, А. Г. Губанова, О. Е. Битютская, Л. Я. Полищук, Н. И. Демьянова // Труды Южного научно-исследовательского института рыбного хозяйства и океанографии. – 1995. – Т. 41. – С. 171-178.
- Радиопротекторы и гипоксия: механизмы комбинированной защиты / И. Б. Ушаков, М. М. Абрамов, Л. Л. Хунандов, В. Г. Зуев – М.: Вооружение. Политика. Конверсия, 1996. – 152 с.
- Радіозахисні властивості 2-меркаптобензотіазолу на клітини in vitro / Х. М. Литвинчук, Г. Й. Лавренчук, В. Р. Гурандо, І. М. Кліщ, А. О. Ковальчук // Здобутки клінічної і експериментальної медицини. – 2018. – № 2. – С. 60-70. – DOI: https://doi.org/10.11603/1811-2471.2018.v0.i2.8914.
- Рождественский Л. М. Средства противолучевой защиты и терапии: современное состояние, проблемы и перспективы / Л. М. Рождественский // Медицинская радиология и радиационная безопасность. – 2012. – Т. 57, № 5. – С. 72-82.
- Рождественский Л. М. Классификация противолучевых средств в аспекте их фармакологического сигнала и сопряженности со стадией развития лучевого поражения // Радиационная биология. Радиоэкология. – 2017. – Т. 57, № 2. – С. 117-135 – DOI: http://dx.doi.org/10.7868/S0869803117020126.
- Современные подходы к организации и проведению мероприятий экстренной медицинской помощи при массовых радиационных поражениях / В. В. Бояринцев, А. Н. Гребенюк, В. И. Легеза, А. А. Тимошевский // Кремлевская медицина. Клинический вестник. – 2017. – № 2. – С. 122-128.
- Средства защиты организма от действия ионизирующего облучения: монография / В. П. Баштан, В. Ф. Почерняева, Т. А. Жукова, Л. Н. Васько, Л. А. Лымарь. – Полтава: Украинская медицинская стоматологическая академия, 2016. – 135 с.
- Сычев К. В. Изыскание средств терапии при сочетанном воздействии на организм внешнего и внутреннего облучения: автореф. дисс. ... канд. биол. наук: 03.01.01, 06.02.03 / Сычев Константин Владимирович. – Казань, 2014. – 23 с.
- Тарутин И. Г. Радиационная защита при медицинском облучении. – Минск: Высшэйшая школа, 2005. – 335 с.
- Узленкова Н. Є. Радіопротектори: сучасний стан проблеми / Н. Є. Узленкова // Український радіологічний журнал. – 2014. – Т. ХХІІ. – Вип. 4. – С. 42-49.
- Ушаков И. Б. Модификация радиоцеребальных эффектов измененной газовой средой / И. Б. Ушаков, В. П. Фёдоров // Радиационная биология. Радиоэкология. – 2018. – Т. 58, № 2. – С. 126-145.
- Ушаков И. Б. Лекарственные средства и природные антиоксиданты как компоненты противорадиационных контрмер в космических полетах / И. Б. Ушаков, М. В. Васин // Медицинская радиология и радиационная безопасность. – 2017. – Т. 62, № 4. – С. 66-78.
- Филимонова М. В. Фармакологические свойства и радиобиологические эффекты линейных и циклических производных изотиомочевины – конкурентных ингибиторов синтаз оксида азота: автореф. дисс. ... доктора биол. наук: 14.03.06, 03.01.01 / Филимонова Марина Владимировна. – Обнинск, 2015. – 47 с.
- Ходаківська О.В. Церебропротекторна активність нових похідних 3,2'-спіро-піроло-2-оксиндолу в умовах ішемічного інсульту (експериментальне дослідження): дис. ... канд. фарм. наук: 14.03.05 / Ходаківська Ольга Віталіївна. – НФАУ МОЗ України, Харків, 2015. – 186 с.
- A basic fibroblast growth factor analog for protection and mitigation against acute radiation syndromes / K. Casey-Sawicki, M. Zhang, S. Kim, A. Zhang, S. B. Zhang, Z. Zhang, R. Singh, S. Yang, S. Swarts, , S. Vidyasagar, L. Zhang, A .Zhang, P. Okunieff // Health Physics. – 2017. – Vol. 106(6). – P. 704-712.
- A new era of low-dose radiation epidemiology / C. M. Kitahara, M. S. Linet, P. Rajaraman, E. Ntowe, A. Berrington de Gonzalez // Current Environmental Health Reports. – 2015. – Vol. 2. – P. 236-249. – DOI: https://doi.org/10.1007/s40572-015-0055-y.
- Ahire V. Ellagic acid: a potent radio-sensitizer in cancer radiotherapy / V. Ahire, K. P. Mishra, G. Kulkarni // Cancer Research Frontier. – 2016. – Vol. 2. – P. 141-155. – DOI: https://doi.org/10.17980/2016.141.
- Bacq Z. M. The amines and particularly cysteamines as protectors against roentgen rays / Z. M.Bacq // Acta radio. – 1954. – № 41. – Р. 47-55. – DOI: https://doi.org/10.1177/028418515404100106.
- Cysteine protection against X-irradiation / H. M. Patt, E. B. Tyree, R. L. Straube, D. M. Smith // Science. – 1949. – № 110 .– Р. 213-214. – DOI: https://doi.org/10.1126/science.110.2852.213.
- COX-2 in radiotherapy: a potential target for radioprotection and radiosensitization / M. Cheki, R. Yahyapour, B. Farhood, A. Rezaeyan, D. Shabeeb, P. Amini, S. Rezapoor, M. Najafi // Current Molecular Pharmacology. – 2018. – Vol. 11(3). – P. 173-183. – DOI: https://doi.org/10.2174/1874467211666180219102520.
- Evaluating the radioprotective effect of curcumin on rat’s heart tissues / S. Kolivand, P. Amini, H. Saffar, S. Rezapoor, E. Motevaseli, M. Najafi, F. Nouruzi, D. Shabeeb, A. E. Musa // Current Radiopharmaceuticals. – 2018. – Vol. 11. – Р. 1-6. – DOI: http://dx.doi.org/10.2174/1874471011666180831101459.
- High-throughput screening identifies two classes of antibiotics as radioprotectors: tetracyclines and fluoroquinolones / K. Kim, Pollard J. M., A. J. Norris, J. T. McDonald, Y ,Sun, E. Micewicz, K. Pettijohn, R. Damoiseaux, K. S. Iwamoto, J. W. Sayre, B. D. Price, R. A. Gatti, W. H. McBride // Clinical Cancer Research. – 2009. – Vol. 15(23). – P. 7238-7245. – DOI: https://doi.org/10.1158/1078-0432.CCR-09-1964.
- Hofer M. Pharmacological modulation of radiation damage. Does it exist a chance for other substances than hematopoietic growth factors and cytokines ? / M. Hofer, Z. Hoferova, M. Falk //International Journal of Molecular Sciences. – 2017 – Vol. 18 (7). – DOI: https://doi.org/10.3390/ijms18071385.
- Inhibition of radiation induced oxidative damage in the lung tissue: May acetylsalicylic acid have a positive role? / C. Demirel, S. C. Kilciksiz, S. Gurgul, N. Erdal, S. Yigit, L. Tamer, L. Ayaz // Inflammation. – 2015. – Vol. 39. – P. 158-165.
- Johnke R. M. Radioprotective agents for radiation therapy: future trends / R. M. Johnke, J. A. Sattler, R. R. Allison // Future Oncology. – 2014. – 10(15). – P. 2345-2357. – DOI: https://doi.org/10.2217/fon.14.175.
- Lee T. K. Radioprotection: the non‐steroidal anti‐inflammatory drugs (NSAIDs) and prostaglandins / T. K. Lee, I. Stupans // Journal of Pharmacy and Pharmacology. – Vol. 54, Iss. 11. – P. 1435-1445. – DOI: http://dx.doi.org/10.1211/00223570254.
- Maier P. Radioprotection of normal tissue cells / P. Maier, F. Wenz, C. Herskind // Strahlentherapie und Onkologie. – 2014. – Vol. 190 (8). – P. 745-752. – DOI: https://doi.org/10.1007/s00066-014-0637-x.
- Mechanisms for radioprotection by melatonin; can it be used as a radiation countermeasure? / P. Amini, H. Mirtavoos-Mahyari, E. Motevaseli, D. Shabeeb, A. E. Musa, M. Cheki, B. Farhood, R. Yahyapour, A. Shirazi, N. A. Goushbolagh, M. Najafi // Current Molecular Pharmacology. – 2018. – № 11. – Р. 1-10. – DOI: https://doi.org/10.2174/1874467211666180802164449.
- Model development and use of ACE inhibitors for preclinical mitigation of radiation induced injury to multiple organs / M. Medhora, F. Gao, Q. Wu, R. C. Molthen, E. R. Jacobs, J. E. Moulder, B. L. Fish // Radiation Research: Official Journal of the Radiation Research Society. – 2014. – Vol. 182(5). – P. 545-555.
- Patyar R. R. Role of drugs in the prevention and amelioration of radiation induced toxic effects / R. R. Patyar S. Patyar // European Journal of Pharmacology. – 2018. – Vol. 819. – P. 207-216. – DOI: https://doi.org/10.1016/j.ejphar.2017.12.011.
- Paul P. Phytochemicals as radioprotective agents – a review / P. Paul, M. K. Unnikrishnan, A. N. Nagappa // Indian Journal of Natural Products and Resources – Vol. 2 (2). – P. 137-150.
- Prostaglandin E2 increases hematopoietic stem cell survival and accelerates hematopoietic recovery after radiation injury / R. L. Porter, M. Georger, O. Bromberg, K. E. McGrath, B. J. Frisch, M. W. Becker, L. M. Calvi // Stem Cells. – 2013. – Vol. 31 (2). – Р. 372-383. – DOI: http://dx.doi.org/10.1002/stem.1286.
- Protective effects of caffeic acid phenethyl ester against acute radiation-induced hepatic injury in rats / J. Chu, X. Zhang, L. Jin, J. Chen, B. Du, Q. Pang // Environmental Toxicology and Pharmacology. – 2015. – Vol. 39(2). – P. 683-389. – DOI: https://doi.org/10.1016/j.etap.2015.01.020.
- Radiation & inflammation / D. Schaue, E. D. Micewicz, J. A. Ratikan, M. W. Xie, G. Cheng, W. H. McBride // Seminars in Radiation Oncology. – 2015. – Vol. 25, (1). – P. 4-10. – DOI: https://doi.org/10.1016/j.semradonc.2014.07.007.
- Radiation protection and mitigation by natural antioxidants and flavonoids: implications to radiotherapy and radiation disasters / R. Yahyapour, D. Shabeeb, M. Cheki, A. E. Musa, B. Farhood, A. Rezaeyan, P. Amini, H. Fallah, M. Najafi //Current Molecular Pharmacology. – 2018. – Vol. 11 (4). – P. 285-304. – DOI: https://doi.org/10.2174/1874467211666180619125653.
- Radioprotective agents to prevent cellular damage due to ionizing radiation / T. A. Smith, D. R. Kirkpatrick, S. Smith, T. K. Smith, T. Pearson, A. Kailasam, K. Z. Herrmann, J. Schubertv, D. K. Agrawal // Journal of Translational Medicine. – 2017. – Vol. 15 (232). – P. 1-18. - DOI: https://doi.org/10.1186/s12967-017-1338-x.
- Radioprotective Agents: Strategies and Translational Advances / M. Z. Kamran, A. Ranjan, N. Kaur, S. Sur, V. Tandon // Medicinal Research Reviews. – 2016. – Vol. 36, No. 3. – P. 461-493. – DOI: https://doi.org/1002/med.21386.
- Radioprotective effect of mefenamic acid against radiation-induced genotoxicity in human lymphocytes / S. J. Hosseinimehr, R. Nobakht, A. Ghasemi, T. A. Pourfallah // Radiation Oncology Journal. – 2015. – Vol. 33 (3). – P. 256-260. – DOI: http://dx.doi.org/10.3857/roj.2015.33.3.256.
- Radiosensitizers, radioprotectors, and radiation mitigators / J. Raviraj, V. K. Bokkasam, V. S. Kumar, U. S. Reddy, V. Suman // Indian Journal of Dental Research. – 2014. – Vol. 25(1). – P. 83-90. – DOI: https://doi.org/10.4103/0970-9290.131142.
- Randomized comparison of single dose of recombinant human IL-12 versus placebo for restoration of hematopoiesis and improved survival in rhesus monkeys exposed to lethal radiation / Z. Gluzman-Poltorak, S. R. Mendonca, V. Vainstein, H. Kha, L. A. Basile // Journal of Hematology & Oncology. – 2014. – Vol. 7 (31). P. 1-12. – DOI: https://doi.org/10.1186/1756-8722-7-31.
- Rosen E. M. New approaches to radiation protection / E. M. Rosen, R. Day, V. K. Singh // Frontiers in Oncology. – 2015. – Vol. 4 (381). – P. 1-15. – DOI: https://doi.org/10.3389/fonc.2014.00381.
- Singh V. K. Colony-stimulating factors for the treatment of the hematopoietic component of the acute radiation syndrome (H-ARS): a review / V. K. Singh, V. L. Newman, T. M. Seed // Cytokine. – 2015. – Vol. 71. – P. 22-37. – DOI: https://doi.org/https://doi.org/10.1016/j.cyto.2014.08.003.
- Singh V. K. Patents for Toll-like receptor ligands as radiation countermeasures for acute radiation syndrome / V. K. Singh, H. B. Pollard // Expert Opinion on Therapeutic Patents. – 2015. – Vol. 25(10). – P. 1085-1092. – DOI: https://doi.org/10.1517/13543776.2015.1064900.
- Targeting the renin-angiotensin system combined with an antioxidant is highly effective in mitigating radiation-induced lung damage / J. Mahmood, S. Jelveh, A. Zaidi, S. R. Doctrow, M. Medhora, R. P. Hill // International Journal of Radiation Oncology, Biology, Physics. – 2014. – Vol. 89. – P. 722–728. – DOI: https://doi.org/10.1016/j.ijrobp.2014.03.048.
- The melatonin immunomodulatory actions in radiotherapy / M. Najafi, A. Shirazi, E. Motevaseli, G. Geraily, F. Norouzi, M. Heidari, S. Rezapoor // Biophysical Reviews. – 2017. – Vol. 9 (2). – P. 139-148. – DOI: https://doi.org/10.1007/s12551-017-0256-8.
