Трифосфат натрію
Трифосфат натрію — сіль триполіфосфорної кислоти Na5Р3О10, харчовий стабілізатор, відомий як Е451.
| Трифосфат натрію | |
|---|---|
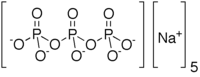 | |
| Назва за IUPAC | Pentasodium triphosphate |
| Інші назви | sodium tripolyphosphate polygon |
| Ідентифікатори | |
| Номер CAS | 7758-29-4 |
| PubChem | 517047 |
| Номер EINECS | 231-838-7 |
| RTECS | YK4570000 |
| SMILES |
[O-]P(=O)([O-])OP(=O)([O-])OP(=O)([O-])[O-].[Na+].[Na+].[Na+].[Na+].[Na+][1] |
| InChI |
InChI=1S/5Na.H5O10P3/c;;;;;1-11(2,3)9-13(7,8)10-12(4,5)6/h;;;;;(H,7,8)(H2,1,2,3)(H2,4,5,6)/q5*+1;/p-5 |
| Властивості | |
| Молекулярна формула | Na5P3O10 |
| Молярна маса | 367,864 г/моль |
| Зовнішній вигляд | white powder |
| Густина | 2,52 г/см3 |
| Тпл | 622 °C |
| Розчинність (вода) | 14,5 г/100 мл (25 °C) |
| Небезпеки | |
| MSDS | ICSC 1469 |
| Індекс ЄС | Not listed |
| NFPA 704 |
 0
2
0
|
| Температура спалаху | Non-flammable |
| Пов'язані речовини | |
| Інші аніони | Trisodium phosphate Tetrasodium pyrophosphate Hexasodium metaphosphate |
| Інші катіони | Pentapotassium triphosphate |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фосфати послаблюють електростатичну взаємодію всередині актоміозінового комплексу. Тільки фосфати можуть розщеплювати актин і міозин, і це є головною причиною повсюдного розповсюдження фосфатів.
Практично всі харчові фосфати та їх суміші, що використовуються в м'ясопереробній та рибній промисловості, мають лужну реакцію. Добавка лужних фосфатів до м'яса і риби призводить до зростання рН, і як наслідок, до збільшення вологозв'язуючий здатності білків.
Пірофосфати (e450) і триполіфосфат (e451) найкраще сприяють емульгування жиру. Споживання понад дозволених норм фосфатів може негативно позначитися на здоров'ї людини, через що відбувається погіршення засвоєння кальцію, що призводить до відкладення в нирках кальцію і фосфору, і сприяє розвитку остеопорозу.
Синтез
Трифосфат натрію синтезується шляхом конденсації з ортофосфорної кислоти:
У лабораторних умовах він синтезується з фосфату натрію та дифосфату натрію:
Також можливий синтез із триметафосфату натрію:[2]
Посилання
- Sodium tripolyphosphate
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 547-8.