EcoRI
EcoRI (читається «еко ер один») — ензим, ендонуклеаза рестрикції, виділена з бактерії E. coli, є частиною рестрикційно-модифікаційної системи бактерії.
| EcoRI | |
|---|---|
 | |
| Ідентифікатори | |
| Символ | EcoRI |
| Інші ідентифікатори | Pfam: |
| Інша інформація | |
У практичній молекулярній біології EcoRI використовується як рестриктаза. EcoRI розрізає дволанцюгову ДНК створюючи 4-нуклеотидний липкий кінець з виступаючим 5'-фрагментом AATT. ДНК-фрагментом, по якому відбувається розрізання, є шестинуклеотидний фрагмент GAATTC/CTTAAG.
Структура
Первинна структура
EcoRI містить амінокислотний мотив PD..D/EXK, який знайдений в активному сайті багатьох рестриктаз.
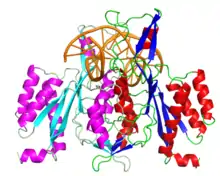
Третинна та четвертинна структура
Ензим утворює гомодимер з двох 31-кДа одиниць, кожна з яких є одним поліпептидним ланцюгом та існує у вигляді глобули з α/β архітектурою. Кожна одиниця в димері містить мотив-«петлю», яка виступає з глобули та зв'язується з ДНК-мішенню при розпізнаванні.[1][2]

EcoRI була закристалізована із ДНК-послідовністю, яку вона зазвичай розпізнає та розрізає (PDB код 1QPS). Аналіз кристалічної структури показав, що одиниці гомодимеру взаємодіють з ДНК симетричним чином.[1] Дві α-спіралі від кожної одиниці сходяться в просторі утворюючи специфічний «затискач».[3] На спіралях амінокислотні залишки Glu144 та Arg145 взаємодіють між собою, що ймовірно обумовлює фізичну комунікацію між активними сайтами обох одиниць.[4]
Мішень
EcoRI розрізає ДНК по паліндромному сайту GAATTC/CTTAAG із утворенням липких кінців. EcoRI є високоспецифічним ензимом, тобто навіть одинична заміна/перестановка нуклеотидів в сайті розпізнавання призводить до сильного зниження афінності рестриктази до цього сайту і як наслідок до втрати здатності розпізнавати і розрізати його. Бактерії використовують цю властивість для захисту власної ДНК від дії рестриктази: другий аденозин в послідовностях GAATTC в бактеріальному геномі є метильованим, внаслідок чого власна ДНК бактерії є стабільною в присутності рестриктази.[5]
Важливим фактором що обумовлює високу селективність рестриктази EcoRI до свого сайту розпізнавання є конформаційна жорсткість тривимірної структури білка. Внаслідок цього білок не може компенсувати збільшення енергії зв’язування через втрату багатьох водневих зв’язків конформаційною перебудовою для пошуків нових контактів у випадку неоптимальної послідовності ДНК.[5]
Застосування
Рестриктази, такі як EcoRI, широко використовуються в молекулярній біології та генетиці, в таких експериментальних процедурах, як, наприклад, молекулярне клонування. Рестриктази (в тому числі EcoRI) генерують липкі кінці, які можна потім сполучити за допомогою ДНК-лігаз. EcoRI може давати неспецифічні продукти рестрикції (star-активність), залежно від умов реакції, таких як низька іонна сила розчину, високий вміст гліцерину, надлишок ензиму, високі значення pH та наявність певних органічних розчинників.[6]
Посилання
- Pingoud, A., Jeltsch, A. (2001). Structure and function of type II restriction endonucleases. Nucl. Acids Res. 29 (18). с. 3705–3727. PMC 55916. PMID 11557805. doi:10.1093/nar/29.18.3705.
- Kurpiewski, M. R., Engler, L. E., Wozniak, L. A., Kobylanska, A., Koziolkiewicz, M., Stec, W. J, Jen-Jacobson, L (2004). Mechanisms of coupling between DNA recognition and catalysis in EcoRI endonucleases. Structure 12. с. 1775–1788. PMID 15458627. doi:10.1016/j.str.2004.07.016.
- Bitinaite, J., D. A. Wah, Aggarwal, A. K., Schildkraut, I. (1998). FokI dimerization is required for DNA cleavage. Proc Natl Acad Sci U S A 95 (18). с. 10570–5. PMC 27935. PMID 9724744. doi:10.1073/pnas.95.18.10570.
- Kim, Y. C., Grable, J. C., Love, R., Greene, P. J., Rosenberg, J. M. (1990). Refinement of EcoRI endonuclease crystal structure: a revised protein chain tracing. Science 249 (4974). с. 1307–1309. PMID 2399465. doi:10.1126/science.2399465.
- Gary D. Stormo. Sequence-specific interactions in protein-DNA complexes // Introduction to Protein-DNA Interactions: Structure, Thermodynamics, and Bioinformatics. — Cold Spring Harbor Laboratory Press, 2013. — P. 53–54. — ISBN 978-1-936113-50-7.
- Архівована копія. Архів оригіналу за 15 жовтень 2012. Процитовано 13 березень 2016.