Іонний добуток води
Іо́нний до́буток води́ — константа автопротолізу води, що визначається як добуток концентрацій протону H+ та гідроксид-іону OH- у воді або водних розчинах.
Розрахунок значення
Вода має здатність до автопротолізу:
- H2O + H2O H3O+ + OH-
У спрощеному вигляді даний процес розглядається як зворотна дисоціація молекул:
- H2O H+ + OH-
Константа рівноваги для дисоціації води має вигляд
Оскільки дисоціація є дуже незначною (наприклад, за температури 25 °C значення константи становить 1,8·10-16 моль/л), знаменник [H2O] приймають як недисоційовану воду, стала концентрація якої становить:
- [H2O] = 1000 г/л : 18 г/моль = 55,56 моль/л
Величина константи рівноваги є постійною за певної температури, тому її об'єднують з концентрацією води у величину іонний добуток води Kw (від англ. water — вода):
- Kw = Kdiss · [H2O] = [H+][OH-]
Значення Kw розраховують, виходячи зі значень константи дисоціації. Наприклад, при температурі 25 °C воно становить:
- Kw = 1,8·10-16 · 55,56 = 10-14 моль²/л²
На практиці часто користуються від'ємними логарифмами значень:
- -lg Kw = pKw
Вплив на значення
| T, °C | H2O | D2O |
|---|---|---|
| 0 | 14,938 | 15,972 |
| 10 | 14,528 | 15,527 |
| 20 | 14,163 | 15,132 |
| 25 | 13,995 | 14,951 |
| 30 | 13,836 | 14,779 |
| 40 | 13,542 | 14,462 |
| 50 | 13,275 | 14,176 |
| 60 | 13,034 | 13,918 |
| 70 | 12,814 | 13,683 |
| 80 | 12,613 | 13,470 |
| 90 | 12,428 | 13,276 |
| 100 | 12,265 | 13,099 |
На величину іонного добутку значною мірою впливає температура, оскільки при її зростанні підвищується ступінь дисоціації речовини. Так, за температури 100 °C показник pKw вже становить 12,265 (проти 14 за стандартної температури 25 °C).
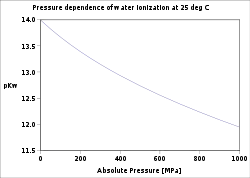 Залежність pKw від тиску
Залежність pKw від тиску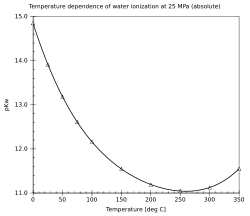 Залежність pKw від температури
Залежність pKw від температури
Застосування
Прикладне значення іонного добутку води спирається на рівняння
- Kw = [H+][OH-]
Виходячи з нього стає можливим розрахунок значень pH та pOH. Наприклад, у нейтральному середовищі концентрації іонів H+ та OH- є рівними:
- [H+] = [OH-] = ; або у логарифмічному вигляді
- pH = pOH = ½pKw
Так, за температури 25 °C значення Kw становить 10-14, тому у нейтральному середовищі pH і pOH дорівнюватимуть:
- [H+] = [OH-] = = 10-7 моль/л; або
- pH = pOH = ½ · 14 = 7
Див. також
Примітки
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — P. 8-85. — ISBN 0-8493-0486-5. (англ.)
Джерела
- Жаровський Ф. Г., Пилипенко А. Т., П'ятницький І. В. Аналітична хімія. — 2-е. — К. : Вища школа, 1982. — С. 232.
- Голуб А. М. Загальна та неорганічна хімія / За ред. Н. І. Сом. — Київ : Вища школа, 1968. — Т. 1. — 441 с.