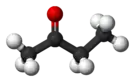
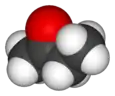
Бутанон
Бутанон (метилетилкетон) — хімічна сполука класу кетонів, безбарвна легколетюча рідина із запахом, що нагадує запах ацетону. Володіє всіма хімічними властивостями, характерними для аліфатичних кетонів, використовується як розчинник і сировина в органічному синтезі.
| Бутанон | |
|---|---|
 | |
 |
 |
 | |
| Інші назви | Метилетилкетон |
| Ідентифікатори | |
| Номер CAS | 78-93-3 |
| PubChem | 6569 |
| Номер EINECS | 201-159-0 |
| KEGG | C02845 |
| ChEBI | 28398 |
| RTECS | EL6475000 |
| SMILES |
CCC(=O)C |
| InChI |
1/C4H8O/c1-3-4(2)5/h3H2,1-2H3 |
| Номер Бельштейна | 741880 |
| Номер Гмеліна | 25656 |
| Властивості | |
| Молекулярна формула | C4H8O |
| Молярна маса | 72,10572 г/моль-1 |
| Зовнішній вигляд | Безбарвна рідина |
| Густина | 0.8050 г/см³ |
| Тпл | -86.3 °C, 187 K, -123 °F |
| Ткип | 79.64 °C, 353 K, 175 °F |
| Розчинність (вода) | 27.5 г/100 мл |
| Показник заломлення (nD) | 1.37880 |
| В'язкість | 0.43 P |
| Структура | |
| Дипольний момент | 2.76 D |
| Небезпеки | |
| ЛД50 | 6,86 мл/кг (перорально, щури) |
| Класифікація ЄС | |
| S-фрази | S2 S9 S16 |
| NFPA 704 |
 3
1
0
|
| Температура спалаху | −9 °C |
| Температура самозаймання | 505 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Добування
У промисловості метилетилкетон отримують з бутенів, що містяться в бутан-бутиленовій фракції газів переробки нафти. Перша стадія — гідратація бутену 70-85%-ної H2SO4 при 30-40 °C і тиску ~ 0,1 МПа в 2-бутанол з проміжним утворенням 2-бутілсульфата CH3CH (OSO3H) C2H5. 2-Бутанол виділяють ректифікацією і перетворюють на метилетилкетон дегідруванням при 400–500 °C (кат.-ZnO на пемзі, цинк-мідний) або окислюють дегідруванням при 500 °C у присутності Ag на пемзі. Селективність гідратації бутен становить 80-85%, дегідрування 2-бутанолу — близько 99%, окислюватиме. гідрування — 85-90%. Недоліки процесу: утворення великої кількості стічних вод на стадії гідратації, високі енерговитрати, пов'язані з необхідністю концентрування H2SO4 (розбавляється при гідратації до 35%-ної). Розроблені та впроваджені (Японія, ФРН) процеси прямої гідратації бутен з використанням гетерополікислот і сульфокатіонітів як каталізаторів, які не мають зазначених недоліків. Перспективно отримання метилетилкетону окисленням бутен на гомогенному кат.-водному розчині солі Pd та оборотно діючого окислювача (наприклад, фосфорномолибденванадиевой гетерополікислоти). У лабораторних умовах метилетилкетон можна отримати дегідруванням 2-бутанолу. Для ідентифікації метилетилкетону синтезують його похідну семікарбазон (темпер. пл. 148 °C) 2,4-дінітрофенілгідразон (темпер. пл. 115 °C).
Світове виробництво бутанону ~ 800 тис. т/рік.
Використання
Застосовують метилетилкетон, як розчинник перхлорвінілових, нітроцелюлозних, поліакрилових лакофарбових матеріалів і клеїв, типографських фарб, депарафінізації мастильних олив та знемаслювання парафінів (видалення суміші масла і низькоплавкого парафіну); проміжний продукт у виробництві пероксиду метилетилкетону (затверджувач поліефірних смол), втор-бутіламіна, метилетилкетон (антиоксидант) і ін.
Вибухонебезпечний в суміші з повітрям при концентрації 1,97-10,2%.
Вплив на людину
При концентрації
- 1 мг/л протягом 3-5 хвилин впливу на людину викликає подразнення слизових оболонок очей, носа і горла.
- 0,2 мг/л подразнення стає нестерпним.
Джерела
- Юкельсон І. І. — Технология основного органического синтеза 354, 423, 445, 530, 539 сл., 581
- Фізер Л., Фізер М. — Органическая химия. Углубленный курс (Том 1) 280, 461, 478