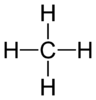
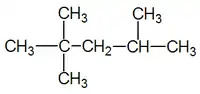
Одинарний зв'язок
Одинарний зв'язок — тип ковалентного хімічного зв'язку між двома атомами утворений двома валентними електронами. Ці два електрони є спільними для атомів, що утворюють цей зв'язок. При такому типу зв'язку кожен атом намагається оточити себе октетом або дублетом електронів, характерним для зовнішнього енергетичного рівня атомів — благородних газів. Окремі валентні електронні пари знаходяться на самій зовнішній електронній оболонці атомів. Їх можна ідентифікувати за допомогою побудови формул Льюїса. Одинарний зв'язок позначається у структурах Люїса через дві крапки (рекомендація ІЮПАК), або рискою між атомами: AːA чи A-A[1].
Ковалентний зв'язок також може бути подвійним або потрійним зв'язком. Одинарний зв'язок енергетично слабший, ніж подвійний або потрійний. Цю різницю міцності зв'язу можна пояснити, вивчивши складові цих типів ковалентних зв'язків. Як правило одинарний зв'язок — це сигма-зв'язок. Виняток становить зв'язок у диборані, який є пі-зв'язком. Подвійний зв'язок, у свою чергу складається з одного сигма-зв'язку та одного пі-зв'язку, а потрійний зв'язок складається з одного сигма-зв'язку та двох пі-зв'язків. Кількісна складова зв'язків — це те, що і визначає їх силу (енергію зв'язку). Цілком очевидно, що одинарний зв'язок є найслабшим із трьох, оскільки він складається лише з сигма-зв'язку, а подвійний зв'язок або потрійний зв'язок складається не тільки з цього одного типу зв'язку, але і з додаткових зв'язків.
Одинарний зв'язок має здатність до обертання, властивістю, якою не володіє подвійний або потрійний зв'язок. Просторова структура пі-зв'язків не дозволяє обертатись (принаймні, не при 298 К). Тому подвійний і потрійний зв'язок, обидва містять пі-зв'язки і утримуються завдяки цій властивості. Сигма-зв'язок не є настільки просторово обмежувальним і атоми зв'язані одинарним зв'язком можуть обертатися, використовуючи сигма-зв'язок як вісь обертання.
Ще одне порівняння властивостей одинарних, подвійних і багатократних зв'язків може бути здійснено за величиною довжини зв'язку. Одинарні зв'язки є найдовшими серед інших типів ковалентних зв'язків, оскільки міжатомне притягнення більше у інших типів, у тому числі подвійних і потрійних. Збільшення кілкості компонентів зв'язку є причиною збільшення цього притягання і зменшення віддалі між атомами, оскільки між атомами з більшою кількістю зв'язків концентрується більше електронів.
Приклади представлення структур молекул із одинарним зв'язком
Примітки
- IUPAC/Goldbook. (англ.)
Джерела
В. В. Григор'єва, В. М. Самійленко, А. М. Сич. Загальна хімія. Київ. Вища школа. 1991. ст. 67 — 74. ISBN 5-11-003667-5