Метан
Мета́н (англ. methane, нім. Methan n) — найпростіша органічна сполука вуглецю з воднем, природний безбарвний газ без запаху, хімічна формула — CH4.
| Метан | |
|---|---|
 | |
| Загальні властивості | |
| Молекулярна формула | CH4 |
| SMILES | C |
| Молярна маса | 16,04 г/моль |
| Зовнішній вигляд | безбарвний газ |
| Номер CAS | [74-82-8] |
| Властивості | |
| Густина і агрегатний стан |
0,717 кг/м³, газ |
| Розчинність в воді | ? г/100 мл (? °C) |
| Температура плавлення | −182,5 °C при 1 атм |
| Температура кипіння | −161,6 °C (111,55 K) |
| Потрійна точка | 90,7 K, 0,11 бар |
| Будова | |
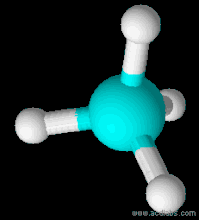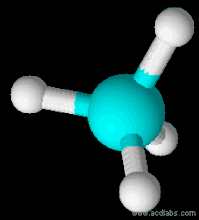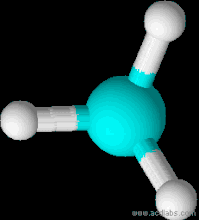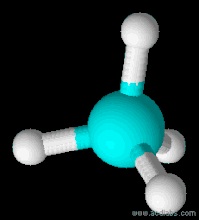
| Форма молекули | Тетраедр |
| Дипольний момент | нуль |
| Небезпека | |
| Температура спалаху |
87,8 °C |
| Температура самозагоряння |
537 °C |
| Межі вибухонебезпеки | 5—15 % |
| Родинні сполуки | |
| Родинні алкани | Етан Пропан |
| Інші сполуки | Метанол Хлорметан |

Метан є основною складовою природного газу. Крім того, він міститься в кам'яновугільних пластах — під час їхньої розробки утворюються вибухонебезпечні суміші метану з повітрям, так званий «рудниковий газ».
Зустрічається в осадовому чохлі земної кори у вигляді вільних скупчень (покладів), в розчиненому (в нафті, пластових і поверхневих водах), розсіяному, сорбованому (породами і органіч. речовиною) і твердому (газогідратному) станах.
При використанні в побуті, до метану звичайно додають одоранти зі специфічним «запахом газу».
Поширення у природі
Метан є основним компонентом:
- газів природних горючих (до 99,5 %),
- нафтових попутних (39—91 %),
- болотяних (понад 99 %) і рудникових (34—48 %) газів;
- присутній у газах грязьових вулканів (понад 95 %),
- спорадично зустрічається у вулканічних газах і в газах магматичних і метаморфічних порід.
Велика кількість метану розчинена у водах океанів, морів, озер. Середній вміст метану у водах Світового океану близько 10-2 см3/л, загальна кількість — 14·1012 м3. Кількість метану, розчиненого у пластових водах, на декілька порядків вища від його промислових запасів.
Метан присутній також в атмосферах Землі, Марсу, Юпітера, Сатурна, Урану; в газах поверхневого ґрунту Місяця. Основна маса метану літо- і гідросфери Землі утворилася при біохімічній і термокаталітичній деструкції розсіяної органічної речовини, вугілля і нафт. Метан утворюється при анаеробному розкладанні органічних речовин, зокрема целюлози (метанове бродіння).
В природі Землі метан досить поширений. Горючі природні гази складаються на 90—97 % з метану. Він утворює багато родовищ, з яких добувається і по газопроводах подається до місця використання. На дні боліт і ставків метан утворюється внаслідок розкладу залишків рослин без доступу повітря. Тому його називають ще болотним газом. Під назвою «рудниковий газ» метан нагромаджується у вугільних шахтах, внаслідок виділення з пластів вугілля і супутніх порід, в яких знаходиться у вільному та зв'язаному вигляді. На діючих шахтах спостерігається виділення метану з вугільних пластів у обсязі до 70—80 м³/т с. б. м. (т с. б. м. — тонна сухої беззольної маси), що робить економічно доцільним його самостійне або супутнє (дегазація) видобування з вугільних родовищ.
Рудниковий газ дуже небезпечний, оскільки з повітрям може утворювати вибухову суміш. Найбільш вибухонебезпечні концентрації метану у повітрі — 9—14 %.
Основний компонент природних (77—99 %), супутніх нафтових (31—90 %), рудникового та болотного газів. Є парниковим газом.
При низьких температурах метан утворює сполуки включення — газові гідрати, що широко розповсюджені в природі.
Газові гідрати — тверді кристалічні речовини густиною 880—890 кг/м3, схожі на сніг або лід. Гідратоутворення відбувається в пористому середовищі осадового чохла з формуванням газогідратних покладів.
Фізичні властивості
Метан — безбарвний газ без запаху і смаку, майже у два рази легший від повітря. У воді малорозчинний. На повітрі або в атмосфері кисню він горить слабкосвітним полум'ям. Його суміш з повітрям або киснем вогне- та вибухонебезпечна.
Має густину за повітрям 0,555 (20 °C); молекулярна маса 16,04, tпл = −182,49 °C, tкип = −161,56 °C, критичний тиск 4,58 МПа, критична температура −82,°С, температура спалаху 87,8 °C, температура самозаймання 537,8 °C.
Будова молекули
Молекулярна формула СН4. Структурна і електронна формули:
Н
|
Н — С - Н
|
H
Молекула метану в декартових координатах (в ангстремах):
C 0.000000 0.000000 0.000000 H 0.000000 0.000000 1.089000 H 1.026719 0.000000 -0.363000 H -0.513360 -0.889165 -0.363000 H -0.513360 0.889165 -0.363000
Молекула метану у вигляді z-матриці:
C H 1 1.089000 H 1 1.089000 2 109.4710 H 1 1.089000 2 109.4710 3 120.0000 H 1 1.089000 2 109.4710 3 -120.0000
Отримання
У лабораторіях метан можна одержати при нагріванні ацетату натрію з твердим гідроксидом натрію або при дії води на карбід алюмінію:
- CH3COONa + NaOH → Na2CO3 + CH4 ↑
- Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 ↑
Хімічні властивості
Перший член гомологічного ряду насичених (метанових) вуглеводнів. Метан являє собою малоактивну в хімічному відношенні речовину. При звичайних умовах він досить стійкий до дії кислот, лугів і окисників. Так, при пропусканні метану через розчин KMnO4, який є досить сильним окисником, він не окислюється і фіолетове забарвлення розчину не зникає. В реакції приєднання (сполучення) метан не вступає, оскільки в його молекулі всі чотири валентності атома вуглецю повністю насичені. Для метану, як і інших насичених вуглеводнів, типовими є реакції заміщення, при яких атоми водню заміщаються атомами інших елементів або атомними групами. Характерна для метану також реакція з хлором, яка відбувається при звичайній температурі під впливом розсіяного світла (при прямому сонячному світлі може статися вибух). При цьому атоми водню в молекулі метану послідовно заміщаються атомами хлору:
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
Внаслідок реакції утворюється суміш хлоропохідних метану.
Також вступає у реакцію сульфохлорування — взаємодію із сумішшю хлору та діоксиду сірки з утворенням метансульфохлориду:
В атмосфері повітря метан горить безбарвним полум'ям з виділенням значної кількості тепла:
- CH4 + 2O2 → СО2 + 2Н2О
З повітрям метан утворює вогненебезпечну вибухову суміш. При нагріванні метану без доступу повітря до температури вище 1000 °C він розкладається на елементи — на вуглець (сажу) і водень:
- CH4 → С + 2Н2
При температурі 1500 °C без доступу кисню і наступному охолодженні відбувається піроліз метану до ацетилену і водню:
- 2CH4 → С2H2 + 3H2
Застосування
.jpg.webp) |
| Паливо |
| Фізичні основи |
|
Сонце · Сонячна радіація |
| Викопне паливо |
|
Вугілля · Горючі сланці · Гідрат метану · Нафта · Природний газ · Торф |
| Природне невикопне паливо |
|
Водорості · Деревина · Рослинні і тваринні жири та олії · Трава |
| Штучне паливо |
|
Біопаливо · Генераторні гази · Кокс · Моторні палива |
| Концепції |
|
Енергетична біосировина |
Велика кількість метану використовується як зручне і дешеве паливо. Неповне спалювання метану дає сажу, яка йде на виготовлення друкарської фарби і як наповнювач каучуку, а при термічному розкладі (вище 1000 °C) одержують сажу і водень, який використовують для синтезу амоніаку. Продукт повного хлорування метану — тетрахлорид вуглецю CCl4 — є добрим розчинником жирів і застосовується для екстрагування жирів із зерен олійних рослин. Метан служить також вихідною речовиною для одержання ацетилену, метилового спирту і багатьох інших хімічних продуктів.
Метан (природний газ, стиснений природний газ - СПГ, CNG) як моторне пальне – найбезпечніший і екологічно чистий вид пального. Використання СПГ як моторного пального зростає завдяки низці переваг у порівнянні з бензиновим і дизельним паливом.
Метан як рудниковий газ
З повітрям метан утворює вибухові суміші. При вмісті в повітрі до 5-6 % метан горить біля джерела тепла (температура запалення 650—750 °С), при вмісті 5-15,2(16)% — вибухає, понад 16 % — може горіти при припливі кисню, зниження при цьому концентрації метану вибухонебезпечне.
Метан має слабку наркотичну дію. ГДК 300 мг/м3. Виділення метану у виробітках шахт створює особливу небезпеку при видобутку вугілля. Розрізняють три форми виділення метану в гірничих виробках: звичайне, суфлярне і раптове. За метановістю, відповідно до «Правил безпеки у вугільних шахтах», шахти поділяють на п'ять категорій. Критерієм такого поділу є відносна метановість, тобто кількість метану у кубометрах, що виділяється за добу на 1 т середньодобового видобутку:
- з виділенням метану до 5 м3/т;
- 5 — 10 м3/т;
- 10 — 15 м3/т;
- надкатегорійні — понад 15 м3/т; небезпечні за суфлярними виділеннями.
Шахти, що розробляють пласти, небезпечні або загрозливі за раптовими викидами вугілля, газу й породи, належать до особливої категорії — небезпечних за раптовими викидами.
Перспективним вважається видобуток метану з вугільних пластів (Див. метаноносність вугільного пласта, метан вугільних родовищ). Наприкінці XX ст. цією проблемою тільки в США займалися науковці бл. 40 університетів, задіяно бл. 100 фірм. Перші промислові спроби використати попутний метан (при вуглевидобутку) провадяться і в Україні, на Донбасі. У промисловості метан застосовують для одержання синтезгазу, ацетилену, хлороформу, чотирихлористого вуглецю, технічного вуглецю та ін. Продукти неповного окиснення метану є вихідними для виготовлення пластмас, використовуються в органічному синтезі.
Цікаві факти
- Чорне море багате на поклади метану, вони виявлені на глибинах 300–1000 м. У центральній глибоководній частині моря запаси оцінюють у 20–30 трлн м3, а загалом у Чорному морі, за прогнозами геологів України і Росії, міститься 60–80 трлн. м3 цього газу.[1] Очікувані запаси газу тільки в осадових породах в українській частині чорноморського дна – 7–10 трлн. м3. Цього, при збереженні рівня споживання 2012 року, вистачить на сто років.[1]
Див. також
- Болотяний газ
- Градієнт метановості вугільних шахт
- Метан вугільних родовищ
- Метанова зона
- Метановість виробок
- Метаноємність вугілля
- Природні горючі гази
- Сигналізатор метану
- Термокондуктометричний датчик метану
Примітки
- Андрушків Б., Вовк І., Погайдак О. Удосконалення економічного інструментарію пошуку нових ресурсів в умовах пострадянського суспільства Архівовано 14 жовтня 2013 у Wayback Machine. // Галицький економічний вісник. Науковий журнал Архівовано 14 жовтня 2013 у Wayback Machine.. — 2012. № 3 (36) (с.:80-81) Архівовано 14 жовтня 2013 у Wayback Machine.
Джерела
- Деркач Ф. А. «Хімія» Л. 1968
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Органічна хімія: Підруч. для студ. вищ. навч. закл. / Л.Д. Бобрівник, В.М. Руденко, Г.О. Лезенко. — К.; Ірпінь: ВТФ "Перун", 2005. — C. 143—144.
Література
- Метан і парниковий ефект атмосфери : (екол., біохім. та мікробіол. аспекти) / Л. І. Сологуб, Г. Л. Антоняк, Г. О. Богданов [та ін.]. − Л. : ПАІС, 2008. − 275 с. : табл. − Бібліогр. : с. 185−275 (1057 назв). − ISBN 978-966-7651-81-7.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.