Перхлорати
Перхлорати — солі перхлоратної кислоти HClO4. Аніон перхлоратної кислоти: ClO−4 — перхлорат-аніон має негативний заряд та тетраедричну симетрію. Хлор у ClO−4 має ступінь окиснення +7.
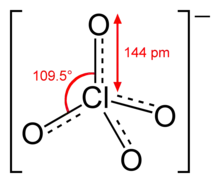
Властивості
Всі перхлорати добре розчиняються у воді. Перхлорат калію KClO4 мало розчинний (1,3 г на 100 г H2O при 25° С). При нагріванні перхлорати стійкі до 300–600° С, вище цієї температури розкладаються з виділенням кисню (наприклад, KClO4 = KCl + 2O2).
Отримання
Отримують перхлорати нагріванням хлоратів, електролізом хлоридів і іншими способами. При електролізі хлоридів виділяється хлор, який адсорбується лужним розчином. При цьому утворюються Гіпохлорити, які диспропорціонують в хлориди та хлорати. Через їх подальший електроліз утворюються перхлорати.
Застосування
Застосовують для виробництва безпечних вибухових речовин (так KClO4 — сильніший окислювач, ніж бертолетова сіль KClO3; в той же час KClO4 стійкий при зберіганні — не вибухає від тертя і удару).
Джерела
- Луцевич Д. Д. Довідник з хімії, Українські технології, Львів 2003, 420 ст.
