Перхлоратна кислота
Перхлора́тна кислота́ HClO4 — найсильніша одноосновна кислота (у водному розчині), безводна — сильний окисник. Вибухонебезпечна. Перхлоратну кислоту та її солі (перхлорати) застосовують як окисники.
| Перхлоратна кислота | |
|---|---|
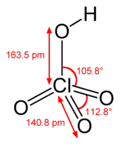 Структурна модель із фізичними параметрами молекули |
 Просторова модель |
 | |
| Систематична назва | Перхлоратна кислота |
| Ідентифікатори | |
| Номер CAS | 7601-90-3 |
| PubChem | 24247 |
| Номер EINECS | 231-512-4 |
| ChEBI | 29221 |
| RTECS | SC7500000 |
| SMILES |
OCl(=O)(=O)=O |
| InChI |
1/ClHO4/c2-1(3,4)5/h(H,2,3,4,5) |
| Номер Гмеліна | 2137 |
| Властивості | |
| Молекулярна формула | HClO4 |
| Молярна маса | 100,46 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 1,67 г/см3 |
| Тпл | -17 °C (азеотропна)[1] -112 °C (безводна) |
| Ткип | 203 C (азеотропна)[2] |
| Розчинність (вода) | змішується |
| Кислотність (pKa) | ≈ −8[3] |
| Небезпеки | |
| MSDS | ICSC 1006 |
| Індекс ЄС | 017-006-00-4 |
| Класифікація ЄС | |
| R-фрази | Шаблон:R5, R8, R35 |
| S-фрази | (S1/2), S23, S26, S36, S45 |
| NFPA 704 |
 0
3
3
OX
|
| Пов'язані речовини | |
| Пов'язані речовини | Хлоридна кислота Гіпохлоритна кислота Хлоритна кислота Хлоратна кислота |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
Перше повідомлення про синтез перхлоратної кислоти міститься у статті Ф. Стадіона[4], який у 1816 році отримав її шляхом перегонки продукту, що утворюється при обережному плавленні хлорату калію в суміші з концентрованою сульфатною кислотою. Ф. Стадіон здійснив важливий внесок у дослідження перхлоратної кислоти не тільки як першовідкривач, а й як дослідник, який вперше отримав її електролізом розчину діоксиду хлору [5]. Пізніше О. Генрі запропонував отримувати перхлоратну кислоту, виходячи з перхлорату калію, оксиду цинку і гексафторсилікатної кислоти[6].
Спосіб Ф. Стадіона був значно спрощений і покращений Натівелем[7].
Властивості
Безбарвна летюча рідина, сильно димить на повітрі, в парах існує у вигляді мономеру. Безводна перхлоратна кислота дуже реакційноздатна та нестійка. Рідка HClO4 частково димеризована. Характерною є для неї рівноважна автодегідратація:
- 3HClO4 ↔ H3O+ + ClO−4 + Cl2O7
HClO4 добре розчинна у хлорорганічних розчинниках, таких, як CF3COOH, CHCl3, CH2Cl2 та ін. Змішування з розчинниками, які проявляють відновні властивості, може призвести до займання та вибуху. З водою перхлоратна кислота змішується в будь-яких співвідношеннях і утворює ряд гідратів HClO4 × nH2O (де n = 0,25 … 4). Моногідрат HClO4 • H2O має високу температуру плавлення (+50 °С). Концентровані розчини перхлоратної кислоти, на відміну від безводної кислоти, мають маслянисту консистенцію. Водні розчини HClO4 стійкі, мають низьку окисну здатність. Перхлоратна кислота з водою утворює азеотропну суміш, киплячу при 203 °C і містить 72% HClO4. Розчини перхлоратної кислоти в хлорвмісних вуглеводнях є суперкислотами. HClO4 є однією з найсильніших неорганічних кислот, в її середовищі навіть кислотні сполуки ведуть себе як основи, приєднуючи протон і утворюючи катіони ацилперхлоратів: P(OH)+4, ClO4−, NO+2, ClO−4. При слабкому нагріванні та при зниженому тиску суміші перхлоратної кислоти з фосфорним ангідридом, відганяється безбарвна масляниста рідина — хлорний ангідрид:
- 2HClO4 + P2O5 → Cl2O7 + 2HPO3
Солі перхлоратної кислоти називаються перхлорати.
Отримання
- Водні розчини перхлоратної кислоти отримують електрохімічним окисненням соляної кислоти або хлору, розчинених у міцній перхлоратній кислоті, а також обмінним розкладанням перхлоратом натрію або калію сильними неорганічними кислотами.
- Безводна перхлоратна кислота виходить при взаємодії перхлоратом натрію або калію з міцною сірчаною кислотою, а також водних розчинів перхлоратної кислоти з олеумом:
- KClO4 + H2SO4 → KHSO4 + HClO4
Застосування
- Концентровані водні розчини перхлоратної кислоти широко використовуються в аналітичній хімії, а також для отримання перхлоратів.
- Перхлоратна кислота застосовується при розкладанні складних руд, при аналізі мінералів, а також як каталізатор.
- Солі перхлоратної кислоти: перхлорат калію|перхлорат калію KClO4 малорозчинні у воді, застосовується у виробництві вибухових речовин, перхлорат магнію Mg(ClO4)2 (ангідрон) — осушувач. Суху перхлоратну кислоту не можна довго зберігати і перевозити, тому що при зберіганні в звичайних умовах вона повільно розкладається, забарвлюється оксидами хлору, що утворюються при її розкладанні, і може мимоволі вибухати.
Література
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л.М.Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0
Примітки
- Safety data for concentrated perchloric acid, ca. 70% msds.chem.ox.ac.uk
- Handling of Perchloric acid ameslab.gov
- Шаблон:Housecroft2nd
- F. Stadion, Liebig's Annalen, 110, 125 (1816). (нім.)
- F. Stadion, Annales de chimie et de physique, 8, 406 (1818). (фр.)
- O. Henry, Journal für praktische Chemie, 17, 486 (1839). (англ.)
- A. D. Nativelle, Journal für praktische Chemie, 26, 405 (1842). (англ.)
Джерела
- Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102 Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Луцевич Д. Д. Довідник з хімії, Українські технології, Львів 2003, 420 ст.
