Фазова діаграма води
Фа́зова діагра́ма води́ — графічне відображення рівноважного стану фаз води (рідини, водяної пари та різних модифікацій льоду). Будується в системі координат температура—тиск.
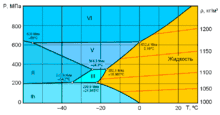
Елементи фазової діаграми
Потрійні точки
| № | Фази | Тиск | Температура | Примітка | |||
|---|---|---|---|---|---|---|---|
| МПа | °C | K | |||||
| 1 | Пар | Вода | Лід Ih | 611,657 Па | 0,01 | 273,16 | |
| 2 | Пар | Лід Ih | Лід XI | 0 | -201,0 | 72,15 | |
| 3 | Вода | Лід Ih | Лід III | 209,9 | -21,985 | 251,165 | |
| 4 | Лід Ih | Лід II | Лід III | 212,9 | -34,7 | 238,45 | [5][6][7] |
| 5 | Лід II | Лід III | Лід V | 344,3 | -24,3 | 248,85 | [5][6] |
| 6 | Лід II | Лід VI | Лід XV | ~ 800 | -143 | 130 | Для D2O[8] |
| 7 | Вода | Лід III | Лід V | 350,1 | -16,986 | 256,164 | [5][6] |
| 8 | Вода | Лід IV | Лід XII | ~ 500—600 | ~ -6 | ~ 267 | |
| 9 | Лід II | Лід V | Лід VI | ~ 620 | ~ -55 | ~ 218 | [10] |
| 10 | Вода | Лід V | Лід VI | 632,4 | 0.16 | 273,32 | [5][6] |
| 11 | Лід VI | Лід VIII | Лід XV | ~ 1500 | -143 | 130 | Для D2O[8] |
| 12 | Лід VI | Лід VII | Лід VIII | 2100 | ~ 5 | ~ 278 | [11][12] |
| 13 | Вода | Лід VI | Лід VII | 2216 | 81,85 | 355 | [5][6] |
| 14 | Лід VII | Лід VIII | Лід X | 62 000 | -173 | 100 | [13] |
| 15 | Вода | Лід VII | Лід X | 47 000 | ~ 727 | ~ 1000 | [14][15] |
Крива сублімації льоду
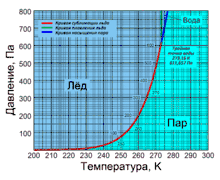
Крива сублімації льоду починається в точці (0 Па; 0 K) і закінчується в потрійній точці води (611,657 Па; 273,16 K). На цій ділянці при зниженні температури тиск сублімації падає експоненціально і при вже температурі 130 K складає незначну величину (10−8 Па).
З гарною точністю тиск сублімації на цій ділянці описується експонентою
где
Помилка цієї формули - не більше 1% в діапазоні температур 240-273,16 K і не більше 2,5% діапазоні температур 140-240 K.
Більш точно крива сублімації описується формулою, рекомендованою IAPWS(англ. International Association for the Properties of Water and Steam — Міжнародна асоціація з вивчення властивостей води і пари)[16]:
где
Крива плавлення льоду Ih
Крива плавлення льоду Ih (тобто звичайного льоду) на фазовій діаграмі в області низьких тисків є в практично вертикальну пряму. Так, при переході від потрійної точки (611 Па) до атмосферного тиску (101 кПа) температура плавлення падає всього на 0,008 K (з 273,16 до 273,15 K). Тиск, необхідне для зниження температури плавлення на 1 K становить близько 132 атм. Крива плавлення по горизонтальній осі займає діапазон температур 251,165-273,16 K (–21,985 ... 0,01 °C). Мінімальна температура плавлення (–21,985 °С) досягається при тиску 208,566 МПа (2058 атм).
Крива плавлення льоду Ih — єдиний фазовий перехід, пов'язаний зі зміною агрегатного стану води, який має зворотний нахил (при збільшенні тиску температура плавлення зменшується). Ця обставина (згідно з принципом ле Шательє) пояснюється тим, що лід Ih має меншу щільність у порівнянні з водою при тому ж тиску. Всі інші модифікації льоду важче води, їх температура плавлення при підвищенні тиску збільшується.
Крива плавлення описується формулою, рекомендованою IAPWS[16]:
где
Крива плавлення льоду III
Крива плавлення льоду III III починається в точці мінімальної температури затвердіння води (251,165 K; 208,566 МПа), де звичайний лід перетворюється на структурну модифікацію III, і закінчується в точці (256,164 K; 350,1 МПа), де проходить межа фаз III і V.
Крива плавлення описується формулою, рекомендованою IAPWS[16]:
где
Крива плавлення льоду V
Крива плавлення льоду V починається в точці (256,164 K; 350,1 МПа), на межі фаз III і V, і закінчується в точці (273,31 K; 632,4 МПа), де проходить межа фаз V та VI.
Крива плавлення описується формулою, рекомендованою IAPWS[16]:
где
Крива плавлення льоду VI
Крива плавлення льоду VI починається в точці (273,31 K; 632,4 МПа), на межі фаз V та VI, і закінчується в точці (355 K; 2216 МПа), де проходить межа фаз VI і VII.
Крива плавлення описується формулою, рекомендованою IAPWS[16]:
где
Крива плавлення льоду VII
Крива плавлення льоду VII починається в точці (355 K; 2216 МПа), на межі фаз VI і VII, і закінчується в точці (715 K; 20,6 ГПа), де проходить межа фази VII.
Крива плавлення описується формулою, рекомендованою IAPWS[16]:
где
Крива насичення водяної пари
Крива насичення водяної пари починається в потрійній точці води (273,16 K; 611,657 Па) і закінчується в критичній точці (647,096 К; 22,064 МПа). Вона показує температуру кипіння води при зазначеному тиску або, що теж саме, тиск насиченої водяної пари при вказаній температурі. У критичній точці щільність водяної пари досягає щільності води і, таким чином, різниця між цими агрегатними станами зникає.
Відповідно до рекомендацій IAPWS, лінія насичення представляється у вигляді неявного квадратного рівняння щодо нормованої температури θ і нормованого тиску β[17]:
де
Для заданого абсолютного значення температури T обчислюється нормоване значенняθі коефіцієнти квадратного рівняння
після чого знаходиться значенняβ
і абсолютне значення тиску:
Тиск насиченої водяної пари (кПа) при різних температурах
| T °C | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 0,6112 | 0,6571 | 0,7060 | 0,7581 | 0,8135 | 0,8726 | 0,9354 | 1,002 | 1,073 | 1,148 |
| 10 | 1,228 | 1,313 | 1,403 | 1,498 | 1,599 | 1,706 | 1,819 | 1,938 | 2,065 | 2,198 |
| 20 | 2,339 | 2,488 | 2,645 | 2,811 | 2,986 | 3,170 | 3,364 | 3,568 | 3,783 | 4,009 |
| 30 | 4,247 | 4,497 | 4,759 | 5,035 | 5,325 | 5,629 | 5,947 | 6,282 | 6,632 | 7,000 |
| 40 | 7,384 | 7,787 | 8,209 | 8,650 | 9,112 | 9,594 | 10,10 | 10,63 | 11,18 | 11,75 |
| 50 | 12,35 | 12,98 | 13,63 | 14,31 | 15,02 | 15,76 | 16,53 | 17,33 | 18,17 | 19,04 |
| 60 | 19,95 | 20,89 | 21,87 | 22,88 | 23,94 | 25,04 | 26,18 | 27,37 | 28,60 | 29,88 |
| 70 | 31,20 | 32,57 | 34,00 | 35,48 | 37,01 | 38,60 | 40,24 | 41,94 | 43,70 | 45,53 |
| 80 | 47,41 | 49,37 | 51,39 | 53,48 | 55,64 | 57,87 | 60,17 | 62,56 | 65,02 | 67,56 |
| 90 | 70,18 | 72,89 | 75,68 | 78,57 | 81,54 | 84,61 | 87,77 | 91,03 | 94,39 | 97,85 |
| 100 | 101,4 |
Див. також
- Правило фаз
- Потрійна точка води
- Фазова діаграма
- Властивості води
- Пружність водяної пари
- Лід-дев'ять
Посилання
- IAPWS. Сайт Міжнародної асоціації з вивчення властивостей води.
- Water Phase Diagram.
- Теплофізичні властивості води і водяної пари.
- Phase-boundary curves of water.
- Saturation vapor pressure formulations.
- Water (Data Page)[недоступне посилання з липня 2019].
Примітки
- L. A.Guildner, D. P. Johnson, and F. E. Jones. Vapor pressure of water at its triple point // J. Res. Nat. Bur. Stand.. — 1976. — Vol. 80A. — P. 505—521.
- M. J. Francis, N. Gulati and R. M. Pashley. The dispersion of natural oils in de-gassed water // J. Colloid Interface Sci.. — 2006. — Vol. 299. — P. 673—677.[недоступне посилання з липня 2019]
- R. M. Pashley, M. Rzechowicz, L. R. Pashley and M. J. Francis. De-gassed water Is a better cleaning agent // J. Phys. Chem.. — 2005. — Vol. 109. — P. 1231—1238.
- R. M. Pashley, M. J. Francis and M. Rzechowicz. The hydrophobicity of non-aqueous liquids and their dispersion in water under de-gassed conditions // Curr. Opin. Colloid Interface Sci.. — 2008. — Vol. 13. — P. 236—244.[недоступне посилання з липня 2019]
- Release on the pressure along the melting and the sublimation curves of ordinary water substance Архівовано 6 жовтня 2008 у Wayback Machine.. IAPWS, 1993.
- P. W. Bridgman Water, in the liquid and five solid forms, under pressure. Proc. Am. Acad. Arts Sci. 47, 1912, 439—558.
- J. L. F. Abascal, E. Sanz, R. G. Fernández, and C. Vega A potential model for the study of ices and amorphous water: TIP4P/Ice. J. Chem. Phys. 122 (2005) 234511.
- C. G. Salzmann, P. G. Radaelli, E. Mayer and J. L. Finney Ice XV: a new thermodynamically stable phase of ice. arXiv:0906.2489v1, cond-mat.mtrl-sci (2009).
- E. A. Zheligovskaya, G. G. Malenkov Crystalline water ices. Russian Chem. Rev. 75 (2006) 57-76.
- L. Mercury, P. Vieillard and Y. Tardy Thermodynamics of ice polymorphs and `ice-like' water in hydrates and hydroxides[недоступне посилання з липня 2019]. Appl. Geochem. 16 (2001) 161—181.
- D. Eisenberg and W. Kauzmann The structure and properties of water. Oxford University Press, London, 1969.
- L. Pauling The structure of water. В кн.: Hydrogen bonding, Ed. D. Hadzi and H. W. Thompson, Pergamon Press Ltd, London, 1959, pp 1-6.
- M. Song, H. Yamawaki, H. Fujihisa, M. Sakashita and K. Aoki Infrared investigation on ice VIII and the phase diagram of dense ices. Phys. Rev. B 68 (2003) 014106.
- B. Schwager, L. Chudinovskikh, A. Gavriliuk and R. Boehler Melting curve of H2O to 90 GPa measured in a laser-heated diamond cell. J. Phys: Condens. Matter 16 (2004) S1177-S1179.
- A. F. Goncharov, N. Goldman, L. E. Fried, J. C. Crowhurst, I-F. W. Kuo, C. J. Mundy and J. M. Zaug Dynamic ionization of water under extreme conditions Архівовано 31 липня 2013 у Wayback Machine.. Phys. Rev. Lett. 94 (2005)125508.
- Revised Release on the Pressure along the Melting and Sublimation Curves of Ordinary Water Substance Архівовано 6 жовтня 2008 у Wayback Machine.. The International Association for the Properties of Water and Steam. Berlin, Germany, September 2008.
- Рівняння лінії насичення: Александров А.А, Орлов К. А., Очков В. Ф. Теплофизические свойства рабочих веществ теплоэнергетики: Интернет-справочник. — М.: Издательский дом МЭИ. 2009.
Література
- J. L. Aragones, M. M. Conde, E. G. Noya, C. Vega. The phase diagram of water at high pressures as obtained by computer simulations of the TIP4P/2005 model: the appearance of a plastic crystal phase // Phys. Chem. Chem. Phys.. — 2009. — № 11. — P. 543–555.
- C. Vega, J. L. F. Abascal, M. M. Conde and J. L. Aragones. What ice can teach us about water interactions: a critical comparison of the performance of different water models // Faraday Discussions. — 2009. — Vol. 141. — P. 251—276.
- C. G. Salzmann, I. Kohl, T. Loerting, E. Mayer and A. Hallbrucker. Pure ices IV and XII from high-density amorphous ice // Can. J. Phys.. — 2003. — Vol. 81. — P. 25—32.
- Александров А.А, Орлов К.А., Очков В.Ф. (2009). Теплофизические свойства рабочих веществ теплоэнергетики: Интернет-справочник. М.: Издательский дом МЭИ. Архів оригіналу за 26 травня 2012. Процитовано 25 вересня 2010.
- Jana Kalovaa and Radim Maresb. Equations for the Thermodynamic Properties at the Saturation Line in the Supercooled Water Region // ICPWS XV : Preprint. — Berlin, September 8-11, 2008. — P. 1–5.
- W. Wagner, A. Saul, A. Pruβ. International Equations for the Pressure along the Melting and along the Sublimation Curve of Ordinary Water Substance // J. Phys. Chem. Ref. Data : Preprint. — 1994. — Vol. 23, № 3. — P. 515—527.
- Percy W . Bridgman. General survey of certain results in the field of high-pressure physics. — December 11, 1946.[недоступне посилання з липня 2019]
- Д. В. Анцышкин, А. Н. Дунаева, О. Л. Кусков. Термодинамика фазовых переходов в системе лед-VI — лед-VII — вода // Геохимия. — 2010. — № 7. — С. 675-684.[недоступне посилання з липня 2019]
- José Teixeira. The «puzzle» of Water Behavior at Low Temperature // Water. — 2010. — № 2. — С. 702-710.
- Wely Brasil Floriano, Marco Antonio Chaer Nascimento. Dielectric Constant and Density of Water as a Function of Pressure at Constant Temperature // Brazilian Journal of Physics. — March, 2004. — Vol. 34, № 1. — С. 38—41.