Потрійна точка
Потрі́йна то́чка — макроскопічний стан речовини, за якого його газоподібна, рідка та тверда форми знаходяться у рівновазі[1]. На фазовій діаграмі такому стану відповідає точка, в якій сходяться криві розділу фаз.
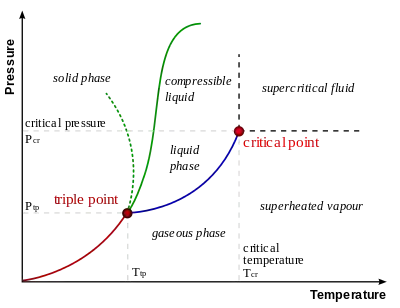
Існує єдине сполучення значень температури та тиску, за яких всі три фази речовини перебувають в стані термодинамічної рівноваги. Ця властивість робить потрійну точку зручним та легко відтворюваним еталоном температури. Зокрема, для води потрійна точка реалізується за температури 0,01 °C і тиску 611.657 Па.
Потрійна точка води використовується для визначення кельвіна — основної одиниці вимірювання термодинамічної температури в Міжнародній системі одиниць (SI). Значення потрійної точки води фіксується за визначенням, а не вимірюється. Потрійні точки кількох речовин використовуються для визначення точок міжнародної температурної шкали ITS-90, починаючи від потрійної точки водню (13.8033 К) і до потрійної точки води (273.16 К, 0.01 °С або 32.018 °F) .
За правилом фаз для однокомпонентної термодинамічної системи потрійна точка єдина.
Співіснування фаз у нерівноважних системах
Твердження про єдиність точки співіснування різних фаз може викликати подив, оскільки начебто суперечить тому, що ми бачимо в повсякденному житті. Сидячи задушливого дня і попиваючи прохолоджувальний напій із льодом, ми спостерігаємо всі три агрегатні стани води: пару, лід і рідину. Пояснення такого явища полягає в тому, що в цих умовах термодинамічна рівновага ще не встановилася: лід у склянці ще не розтопився, і вода ще не випарувалася.
Примітки
- Рейф Ф. Статистическая физика: Учебн. руковод. Пер. с англ./Под ред. А. И. Шальникова и А. О. Вайсберга. — 3-е изд., испр. — М.: Наука. Гл. ред. физ.-мат. лит., 1986. — (Берклеев. курс физики). — 336 с., ил.