Щавлева кислота
Щавле́ва кислота́ (оксала́тна кислота́) —тверда кристалічна речовина білого кольору без запаху, тоне і легко розчинна у воді (80г/л). Це слабка кислота, проте є однією з найсильніших органічних кислот. В природі найчастіше міститься у вигляді кальцієвих солей (оксалати). Міститься у щавлі, шпинаті, бегонії — 10-16 %. Оксалат кальцію може відкладатися у суглобах чи формувати камені у сечовивідних шляхах.
| Щавлева кислота | |
|---|---|
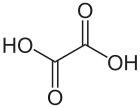 Структурна формула щавлевої кислоти | |
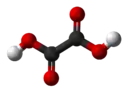 Кульково-стриженева модель |
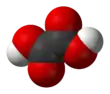 Простірзаповнююча модель |
| Назва за IUPAC | етандіонова кислота |
| Ідентифікатори | |
| Номер CAS | 144-62-7 |
| PubChem | 971 |
| Номер EINECS | 205-634-3 |
| DrugBank | DB03902 |
| KEGG | C00209 |
| Назва MeSH | Oxalic+acid |
| ChEBI | 16995 |
| RTECS | RO2450000 |
| SMILES |
C(=O)(C(=O)O)O |
| InChI |
InChI=1S/C2H2O4/c3-1(4)2(5)6/h(H,3,4)(H,5,6) |
| Номер Бельштейна | 385686 |
| Номер Гмеліна | 2208 |
| 3DMet | B00059 |
| Властивості | |
| Молекулярна формула | C2H2O4 |
| Молярна маса | 90,03 г/моль |
| Молекулярна маса | 89,995308552 г моль−1 |
| Зовнішній вигляд | Білі кристали |
| Густина | 1,90 г см−3 |
| Тпл | 191 |
| Розчинність (вода) | 90 г дм−3 (при 20 °C) |
| Кислотність (pKa) | 1,25, 4,14[1] |
| Небезпеки | |
| MSDS | External MSDS |
| NFPA 704 |
 1
3
0
|
| Температура спалаху | 166 °C |
| Пов'язані речовини | |
| Пов'язані речовини | Оксаліл хлорид Оксалат натрію Оксалат кальцію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Отримання
Щавелеву кислоту отримують окисненням етиленгліколю:
ЇЇ також можна отримати при нагріванні форміату натрію. В результаті утворюється оксолат натрію. Потім до нього додають кислоту:
Хімічні властивості
Двоосновна кислота (HOOC-COOH), може розпадатися на іони:
; pKa = 1,27
; pKa = 4,28
При взаємодії з лугами утворює гідрооксалати та оксалати:
Щавле́ва кислота особливо здатна до декарбоксилювання — руйнування карбоксильної групи:
У концентрованій сульфатній кислоті розкладається на оксид карбону, діоксид карбону та воду:
При окисненні розкладається на вуглекислий газ та воду:
Література
- Кузнецов Д. Г. Органическая химия: Учебное пособие. — СПб.: Издательство «Лань», 2016. — 556 с. ISBN 978-5-8114-1913-5
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.
- O. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.
Примітки
- Bjerrum, J., et al. Stability Constants, Chemical Society, London, 1958.