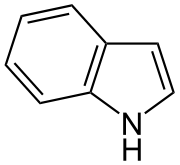
Індол
Індо́л — ароматична гетероциклічна органічна сполука, що складається з конденсованих бензольноного та пірольного кілець. Цей гетероцикл є основним структурним елементом амінокислоти триптофан.
| Індол | |
|---|---|
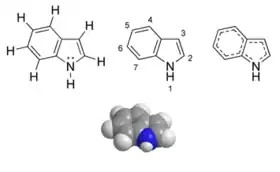 Будова молекули індолу | |
 | |
| Назва за IUPAC | Індол |
| Інші назви | 2,3-Бензопірол, кетол, 1-бензазол |
| Ідентифікатори | |
| Номер CAS | 120-72-9 |
| PubChem | 798 |
| Номер EINECS | 204-420-7 |
| DrugBank | 04532 |
| KEGG | C00463 |
| ChEBI | 16881 |
| RTECS | NL2450000 |
| SMILES |
c1ccc2c(c1)cc[nH]2 |
| InChI |
InChI=1S/C8H7N/c1-2-4-8-7(3-1)5-6-9-8/h1-6,9H |
| Номер Бельштейна | 107693 |
| Номер Гмеліна | 3477 |
| Властивості | |
| Молекулярна формула | C8H7N |
| Молярна маса | 117,15 г/моль |
| Зовнішній вигляд | Біла тверда речовина |
| Густина | 1,1747 г/см³ |
| Тпл | 52—54 °C |
| Ткип | 253—254 °C (526 K) |
| Розчинність (вода) | 0,19 г/100 мл (20 °C) Розчинний у гарячій воді |
| Кислотність (pKa) | 16,2 (21,0 в ДМСО) |
| Основність (pKb) | 17,6 |
| Структура | |
| Кристалічна структура | Pna21 |
| Дипольний момент | 2,11 Д |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Індол — це безбарвні кристали з неприємним запахом екскрементів, однак за дуже малих концентрацій має приємний запах жасмину, застосовується в парфумерії. [1]
Історія
Хімія індолу розвивалась завдяки популярному барвнику індиго. Індол було отримано з індиго через ізатин та оксиіндол Беєром в 1886 році[2] Він же й встановив його будову.[3]
Міститься в кількості до 2,5% у висококиплячій фракції кам'яновугільної смоли, в олії жасмину, та інших квітів, у дьогті, у фекаліях. [1]
Отримання
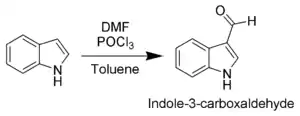
Індол промислово отримують з вугілля. Похідні можуть бути синтезовані багатьма способами.[4][5][6]
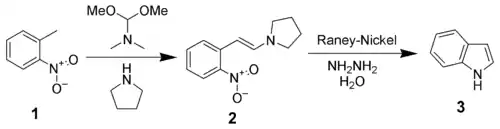
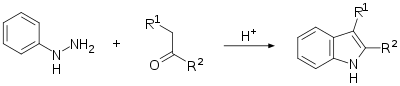
Синтез за Фішером:
Хімічні властивості
Як і пірол, індол є дуже слабкою основою (pK спряженої кислоти −3.6). N-H група може виступати як слабка кислота (pK 21 в ДМСО). Індол легко окиснюється киснем повітря з утворенням індоксил, який здатний до радикальної димеризації. Саме цими процесами обумовлена нестійкість індолу на повітрі.
Електрофільне заміщення
Електрофільне заміщення йде по положенню 3, швидкість заміщення в 1013 рази більша, ніж в бензені.
N-H кислотність
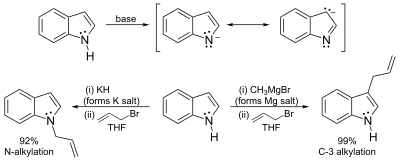
Індол є слабкою кислотою (pK=21 в ДМСО). Його можна депротонувати сильними основами типу гідриду калію чи бутиллітію. Утворені металорганічні сполуки індолу можуть реагувати з електрофілами, як по атому нітрогену, так і в положення 3, залежно від ступеня іонності зв'язку. Більш іонні сполуки матимуть схильність до N-заміщення, а менш іонні - до реакцій по C3. Так само й розчинники, що сприяють кращій іонізації (скажімо ДМСО чи ДМФА) направлятимуть реакцію по положенню N1, а аполярні розчинники - по положенню C3.[7]
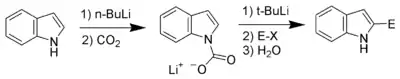
С-H кислотність і літіювання по положенню 2
N-заміщені індоли реагують з сильним основами (типу бутиллітію) селективно по позиції С2. Провести аналогічні реакції в незаміщеному індолі можна скориставшись підходом Бергмана[8]
Окислення
Індольна система багата електронами й тому індол може легко окислюватися навіть відносно слабкими окисниками типу N-бромсукциніміду (NBS)
Більш вагоме значення має окислення індолу в індиго
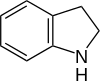
Відновлюючи індол воднем у присутності каталізатора платини отримують індолін.
.
.
Примітки
- Снітинський В.В., Федевич Є.В., І.Є. Соловодзінська, Р.С. Шкумбатюк, О.І. Віщур (2016). Органічна хімія (українська). Львів: СПОЛОМ. с. 300. ISBN 978-966-919-212-7.
- Adolf von Baeyer (1866). Ueber die Reduction aromatischer Verbindungen mittelst Zinkstaub. Ann. 140: 295. doi:10.1002/jlac.18661400306.
- Adolf von Baeyer; Emmerling, A. (1869). Synthese des Indols. Chemische Berichte 2: 679. doi:10.1002/cber.186900201268.
- Gribble G. W. (2000). Recent developments in indole ring synthesis—methodology and applications. J. Chem. Soc. Perkin Trans. 1: 1045. doi:10.1039/a909834h.
- Cacchi, S.; Fabrizi, G. (2005). Synthesis and Functionalization of Indoles Through Palladium-catalyzed Reactions. Chem. Rev. 105 (7): 2873. PMID 16011327. doi:10.1021/cr040639b.
- Humphrey, G. R.; Kuethe, J. T. (2006). Practical Methodologies for the Synthesis of Indoles. Chem. Rev. 106 (7): 2875. PMID 16836303. doi:10.1021/cr0505270.
- Heaney, H.; Ley, S. V. (1974). 1-Benzylindole. Organic Syntheses 54: 58. doi:10.15227/orgsyn.054.0058.
- Bergman, J.; Venemalm, L. (1992). Efficient synthesis of 2-chloro-, 2-bromo-, and 2-iodoindole. J. Org. Chem. 57 (8): 2495. doi:10.1021/jo00034a058.
Посилання
- Методи отримання Індолу (англ.)
Джерела
- Indoles Part One, W. J. Houlihan (ed.), Wiley Interscience, New York, 1972.
- Sundberg, R. J. (1996). Indoles. San Diego: Academic Press. ISBN 0-12-676945-1.
- Joule, J. A.; Mills, K. (2000). Heterocyclic Chemistry. Oxford, UK: Blackwell Science. ISBN 0-632-05453-0.
- Joule, J., In Science of Synthesis, Thomas, E. J., Ed.; Thieme: Stuttgart, (2000); Vol. 10, p. 361. ISBN 3-13-112241-2 (GTV); ISBN 0-86577-949-X (TNY).
- Органічна хімія [Текст] : підручник для вищих навчальних закладів / В.В. Снітинський, Є.В. Федевич, І.Є. Соловодзінська, Р.С. Шкумбатюк, О.І. Віщур. – Львів : СПОЛОМ, 2016. – 300 с. : рис., іл.