Бензен
Бензе́н (також бензо́л) — перший представник гомологічного ряду ароматичних вуглеводнів, молекулярна формула C6H6. Безбарвна летка рідина з характерним запахом. Вперше отриманий Майклом Фарадеєм з конденсату піролізу китового жиру в 1825 році.
| Бензен | |
|---|---|
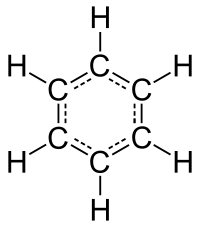 Структурна формула, запропонована Кекуле |
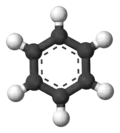 Кульково-стриженева модель |
 {{{ImageAltL2}}} Формула скелету бензену |
 Просторова модель |
| Назва за IUPAC | Бензен |
| Інші назви | Бензол Циклогекса-1,3,5-трієн [6]-анулен |
| Ідентифікатори | |
| Номер CAS | 71-43-2 |
| PubChem | 241 |
| Номер EINECS | 200-753-7 |
| KEGG | C01407 |
| ChEBI | 16716 |
| RTECS | CY1400000 |
| SMILES |
c1ccccc1 |
| InChI |
1/C6H6/c1-2-4-6-5-3-1/h1-6H |
| Номер Бельштейна | 969212 |
| Номер Гмеліна | 1671 |
| Властивості | |
| Молекулярна формула | C6H6 |
| Молярна маса | 78,11 г/моль |
| Зовнішній вигляд | Безбарвна рідина |
| Густина | 0,8765(20) г/см³ |
| Тпл | 5,5 °C, 278,7 K |
| Ткип | 80,1 °C, 353,3 K |
| Розчинність (вода) | 1,8 г/л (15 °C) [1] |
| Діелектрична проникність (ε) | 2,3 (за 25 °C) |
| Показник заломлення (nD) | 1,50112 |
| В'язкість | 0,652 Па•с за 20 °C |
| Дипольний момент | 0 Д |
| Небезпеки | |
| Класифікація ЄС | Канцероген категорії 1 Мутаген категорії 2 |
| NFPA 704 |
 3
2
0
|
| Температура спалаху | −11,63 °C, 262 K |
| Температура самозаймання | 595 °C |
| Пов'язані речовини | |
| Пов'язані речовини | толуен етилбензен ксилени |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
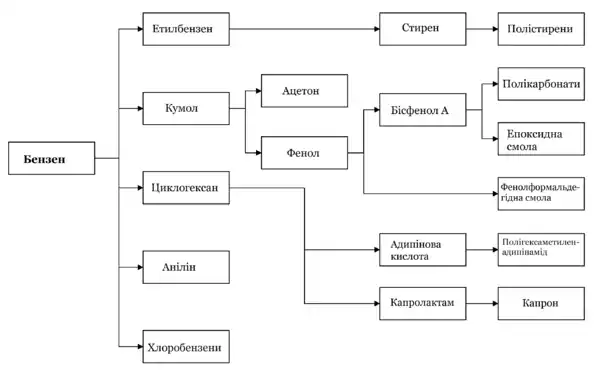
Промислово бензен добували із фракцій кам'яновугільної смоли, але з середини 20-го сторіччя практично весь промисловий об'єм бензену виробляється дегідрогенізацією нафтової сировини. Бензен має цінні властивості як розчинник, але через його високу токсичність і канцерогенність таке використання наразі дуже обмежено. Ця сполука є сировиною для промислового органічного синтезу, більше двох третин бензену іде на виробництво циклогексану, кумолу та етилбензену.
Історія дослідження
Бензен — перший із відкритих людиною аренів. У чистому вигляді він був виділений Майклом Фарадеєм шляхом дистиляції та кристалізації зі світного газу, що є продуктом високотемпературного розкладу китового жиру, і використовувався у вуличних ліхтарях. Тоді ж була встановлена відносна густина його пари та кількісне співвідношення між атомами елементів, що входять до його складу, на основі цих даних Фарадей обрахував емпіричну формулу — C2H2. Помилка у формулі була зроблена через те, що на той час вважалось, що атомна маса Карбону становить 6 а.о.м.. 1834 року Мітчерліх виділив бензен шляхом сухої дистиляції бензойної кислоти із вапном, він встановив правильну емпіричну формулу (C6H6) і назвав цю сполуку «бензином» від бензойної кислоти[2] Проте Лібіх запропонував використовувати назву бензол, закінчення якої взяте зі слова нім. Öl — олія. Сучасна назва «бензен» рекомендується до використання IUPAC у зв'язку з тим, що суфікс -ол відповідає спиртам[3]. 1860 року Кекуле назвав бензен та інші сполуки з подібними властивостями ароматичними, через те, що більшість із них мали приємний запах.[4]
| Історичні формули бензену, зліва направо: Клауса (1867), Дюара (1867), Ладенбурга (1869), Армстронга-Байєра (1887), Тіле (1899), Кекуле (1865) | |
.png.webp) |
 |
| Формули Кекуле із публікації 1872 року | Формула Полінга |
.
На час встановлення правильної емпіричної формули бензену написання структурних формул органічних сполук ще не було прийнятим у хімії. Проте навіть після того, як для багатьох аліфатичних вуглеводнів були запропоновані структурні формули, для бензену це було зробити складніше: формула C6H6 свідчила про належність цієї сполуки до ненасичених вуглеводнів, проте бензен на відміну від алкенів та алкінів краще вступає в реакції заміщення ніж приєднання. У 1865 році Кекуле запропонував для бензену структурну формулу у вигляді шестичленного циклу з трьома подвійними зв'язками, що чергуються з одинарними. Широко відомими є твердження про те, що ідея циклічної структури бензену прийшла до Кекуле, коли йому наснився змій, що кусає себе за хвіст. У пізніших описах сну згадується про шістьох мавп, які тримають одна одну за задні лапи. Насправді циклічну структуру бензену вперше опублікував у своїй книжці австрійський хімік Йозеф Лошмідт 1861 року і Кекуле бачив це видання[5].
Формули Кекуле не могли пояснити деяких особливостей бензену, наприклад того, що не існувало двох різних ізомерів 1,2-диметилбензену. 1872 року вчений опублікував статтю, в якій зазначав, що хоча для бензену можна припустити існування двох різних валентних ізомерів, реальна сполука є середнім між цими двома внаслідок осциляції (переходу) подвійних зв'язків[4][2]. Проте навіть таке доповнення не могло пояснити відмінність бензену від відомих ненасичених вуглеводнів, тому інші вчені продовжували пропонувати альтернативні варіанти структури цієї речовини. Серед них можна відзначити формули Дюара 1867 року та призматичну структуру Ладенбурга (1869). Зараз відомо, що такі сполуки справді можна синтезувати, вони є валентними ізомерами бензену[2].
Із пояснень властивостей бензену запропонованих до відкриття природи ковалентного зв'язку, найближчим до сучасного є теорія «парціальних валентностей» (від лат. partialis — частковий) запропонована Тіле 1899 року. Згідно з нею атоми Карбону в ненасичених сполуках мають часткові вільні валентності, які в молекулі бензену «замикаються» між собою, внаслідок чого різниця між одинарними і подвійними зв'язками зникає. Створення теорії ковалентного зв'язку дозволило краще зрозуміти структуру бензену, 1926 року Інгольд зробив припущення, що в молекулі цієї сполуки електрони π-зв'язків зміщені до простих σ-зв'язків, внаслідок чого вони не існують в ізольованому стані, а вирівнюються між одинарними. Пізніше Лайнус Полінг виходячи із квантово-механічних уявлень, запропонував вважати, що в молекулі бензену відсутні окремі π-зв'язки, а всі їхні електрони об'єднані у суцільну π-хмару[4].
У науковій літературі на позначення бензену використовують як формулу Полінга, так і формули Кекуле, хоча останні і не відображають структуру цієї молекули коректно.
Фізичні властивості

Бензен — безбарвна рідина зі своєрідним запахом. Густина — 0.88 г/см³. За температури 80.1 °C кипить, а за 5.5 °C замерзає в білу кристалічну масу.
Бензен завдяки своїй симетричності є неполярною речовиною, тому не розчиняється у воді, проте утворює з нею азеотропну суміш (91.17 мас%) з температурою кипіння 69.25 °C. З більшістю неполярних розчинників змішується в будь-яких відношеннях, сам є добрим розчинником для багатьох органічних речовин.
В ультрафіолетовій ділянці спектру поглинання проявляється рядом смуг тонкої структури із відстанню між ними 5—6 нм (найінтенсивніше воно спостерігається в діапазоні 170–120 нм і менше в діапазоні — 270–240 нм).[4]
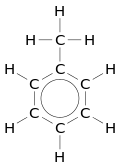
Будова
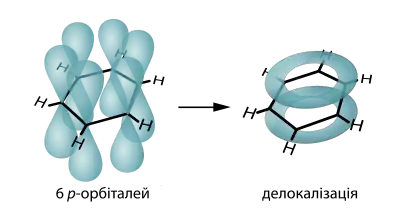
Молекулярна формула — C6H6. Рентгенографічними методами встановлено, що молекула бензену має форму плоского шестикутника з атомами Карбону у вершинах. Усі C—C зв'язки мають однакову довжину, що становить 0.140 нм. Це більше ніж у подвійного (0.134 нм) зв'язку і менше ніж в одинарного (0.154 нм) зв'язку. Бензен є неполярною сполукою з нульовим дипольним моментом (μ) [4].
Всі атоми Карбону в молекулі бензену перебувають у стані sp2-гібридизації. Tри гібридні орбіталі розташовані під кутом 120°, утворюючи C—C та C—H σ-зв'язки. Hегібридні p-орбіталі розташовані перпендикулярно до площини молекули, утворюючи суцільне електронне кільце. З точки зору теорії валентних зв'язків це кільце можна розглядати як суперпозицію двох резонансних структур уявного 1,3,5-циклогексатрієну з ізольованими подвійними C=C зв'язками. З точки зору теорії молекулярних орбіталей його можна розглядати як результат делокалізації уздовж шести атомів Карбону трьох π-орбіталей подвійних C=C зв'язків. Наслідком делокалізації є менша вільна енергія (більша стабільність) бензену порівняно з 1,3,5-циклогексатрієном. Ця різниця в енергії називається енергією спряження, делокалізації або резонансу. Її можна обчислити спираючись на теплоти гідрування циклогексену та бензену:
- теплота гідрування ціклогексену становить 120 кДж/моль;
- тоді очікувана теплота гідрування 1,3,5-циклогексатрієну має становити близько 3×120 кДж/моль = 360 кДж/моль;
- насправді теплота гідрування бензену становить 208 кДж/моль;
- тоді енергія спряження становить 360 кДж/моль — 208 кДж/моль = 152 кДж/моль[4].
Утворення суцільної π-хмари, що містить шість електронів, надає молекулі бензену так званого ароматичного характеру. Карбоновий скелет молекули бензену з таким характером зв'язку називають бензеновим кільцем, або бензеновим ядром[4].
Хімічні властивості
Внаслідок значної стійкості π-хмари для бензену, на відміну від неароматичних ненасичених вуглеводнів, найхарактерніші реакції заміщення, а не приєднання, оскільки вони мали б призводити до втрати ароматичності, проте реакції приєднання також можуть відбуватись за достатньо жорстких умов. Заміщення відбувається за електрофільним механізмом. Також бензен вступає в реакції окиснення.
Реакції електрофільного заміщення
Бензен вступає в реакції електрофільного заміщення, що відбуваються за таким механізмом: на першій стадії відбувається утворення π-комплексу між електрофілом (у формі катіону або сильно поляризованої молекули Eσ+-Nuσ−) та молекулою бензену, внаслідок перекривання НСМО електрофілу із ВЗМО (π-хмарою) бензену. Після цього пара p-електронів виходить із спряженого бензольного кільця і бере участь в утворенні σ-зв'язку із електрофілом, таким чином π-комплекс перетворюється у σ-комплекс або інтермедіат Уелланда. Ця проміжна сполука має позитивний заряд і позбавлена ароматичного характеру, через що є менш стійкою порівняно із ароматичним кільцем, в яке зазвичай швидко перетворюється внаслідок відщеплення протона (цей етап відбувається через ще один проміжний π-комплекс).[4]
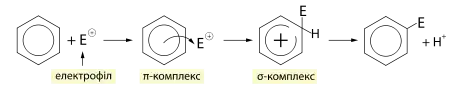
Алкілювання та ацилювання за Фріделем-Крафтсом
Алкілювання бензену здійснюється алкілгалогенідами, алкенами та спиртами, ацилювання — карбоновими кислотами, галогенангідридами та ангідридами, обидва типи реакцій каталізуються кислотами Люїса. Ці реакції названо на честь їх першовідкривачів Шарля Фріделя та Джеймса Крафтса.
Роль каталізатора в цьому типі реакцій полягає у тому, що він взаємодіє із алкілюючим чи ацилюючим реагентом і забезпечує утворення карбкатіону або поляризованого комплексу. Наприклад при взаємодії хлорметану та алюміній хлориду утворюється комплекс із підсиленою електрофільністю атома карбону:

Прикладом реакції алкілювання може бути етилювання бензену хлоретаном.

Проте у промисловості етилбензен частіше отримують реакцією з етиленом, яка також проходить за присутності оксиду алюмінію, фосфатної або сульфатної кислоти:
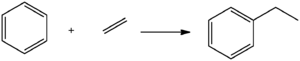
Продуктами реакцій ацилювання бензену є ароматичні кетони. Прикладом може бути реакція із ацетилхлоридом, продуктом якої є метиларилкетон:
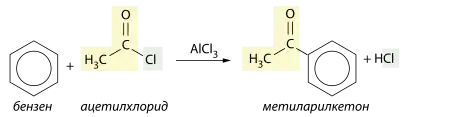
Галогенування
На відміну від ненасичених вуглеводнів бензен не знебарвлює бромну воду. Але для нього характерні реакції галогенування, що відбуваються за механізмом електрофільного заміщення, у присутності кислот Льюїса. Наприклад при взаємодії із бромом утворюється бромбензен:

Нітрування
Характерною для бензену є реакція нітрування для якої використовують нітруючу суміш, яка складається із концентрованої нітратної кислоти та концентрованої сульфатної кислоти як водовіднімаючого засобу. В цій реакції утворюється нітробензен, що є попередником у синтезі аніліну

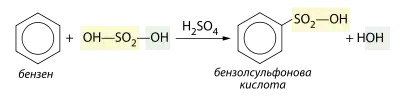
Сульфування
При дії на бензен концентрованої сульфатної кислоти відбувається його сульфування з утворенням бензосульфонової кислоти, що може бути попередником у синтезі фенолу:
Реакції приєднання
Бензен вступає і в реакції приєднання, але значно важче, ніж у реакції заміщення. При цьому він виявляє властивості ненасичених вуглеводнів. Так, у присутності нікелевого каталізатора і при нагріванні відбувається реакція гідрування бензену з утворенням циклогексану:

При цьому атоми Гідрогену приєднуються молекулою бензену за рахунок розриву подвійних зв'язків. Бензен вступає також у реакцію приєднання однієї, двох або трьох молекул хлору. Ця реакція відбувається за вільнорадикальним механізмом, для утворення радикалів хлору необхідне ультрафіолетове світло (досягається опроміненням ртутно-кварцовою лампою). Продуктом повного приєднання є гексахлорциклогексан:
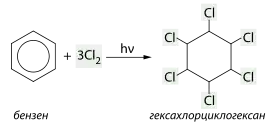
Реакції окиснення
На повітрі бензен горить сильно кіптявим полум'ям, оскільки вміст Карбону у ньому значний. Суміш пари бензену з повітрям вибухова. Завдяки ароматичному характеру бензен стійкий до дії окисників: не окиснюється розчином перманганату калію і нітратною кислотою. У присутності каталізатора ванадій(V) оксиду реагує із молекулярним киснем, внаслідок чого утворюється малеїновий ангідрид:

Також бензен окиснюється озоном, ця реакція історично використовувалась для встановлення його будови.
Одержання і виробництво
На сьогодні існує кілька принципово різних способів виробництва бензолу.
- Коксування кам'яного вугілля. Цей процес історично був першим та служив основним джерелом бензолу до Другої світової війни. Останнім часом частка бензолу, одержуваного цим способом, становить менше 10 %. Слід додати, що бензол, одержуваний з кам'яновугільної смоли, містить значну кількість тіофена, що робить такий бензол сировиною, непридатним для ряду технологічних процесів.
- Каталітичний риформінг (аромайзинг) бензинових фракцій нафти. Цей процес є основним джерелом бензолу в США. У Західній Європі, Росії та Японії цим способом отримують 40—60 % від загальної кількості сполуки. У цьому процесі крім бензолу утворюються толуол та ксилоли. З огляду на те, що толуол утворюється в кількостях, що перевищують попит на нього, його також частково переробляють в: бензол — методом гідродеалкілірування; суміш бензолу та ксилолів — методом диспропорціонування;
- Піроліз бензинових та більш важких нафтових фракцій. До 50 % бензолу виробляється цим методом. Поряд з бензолом утворюються толуол та ксилоли. У деяких випадках всю цю фракцію направляють на стадію деалкілірування, де і толуол, і ксилоли перетворюються на бензол.
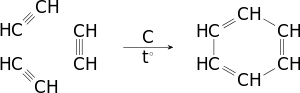
- Тримеризація ацетилену.
- При пропусканні ацетилену при 600 °C над активованим вугіллям з хорошим виходом утворюється бензен та інші ароматичні вуглеводні (реакція М. Д. Зелінського):
- 3С2Н2 → С6H6,
- або
Застосування
Бензен є важливою сировиною для хімічної промисловості. Великі кількості його йдуть для одержання нітробензену, який за реакцією М. М. Зініна відновлюють в анілін:
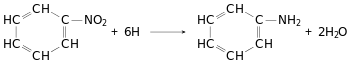
У техніці цю реакцію проводять при дії на бензен хлоридної кислоти в присутності залізних стружок. Залізо, реагуючи з кислотою, утворює водень, який у момент виділення відновлює нітробензен. З аніліну синтезують найрізноманітніші органічні барвники і фармацевтичні препарати. Значні кількості бензену використовують для синтезу фенолу, який йде на виробництво фенолформальдегідних смол. Гексахлороциклогексан, який одержують з бензену (реакція наведена вище), під назвою гексахлоран застосовується в сільському господарстві як один з найефективніших засобів для знищення комах. Крім того, бензен використовують для синтезу багатьох інших органічних сполук і як розчинник
 |
Отримання | Речовина | Застосування | |
| + Cl2/AlCl3 → C6H5Cl | + Cl2/AlCl3 → 1,4-дихлорбензен | 1,4-дихлорбензен | Інсектицид | |
| + NaOH/Cu → Фенол | Фенол | Розчинник, реагент для органічного синтезу, пластмаси, барвники, ліки, вибухівка | ||
| + H2SO4 → Бензосульфонова кислота (C6H5-SO2OH) + NaOH → Фенол | ||||
| + Пропен (CH3-CH=CH2) → Кумен (C6H5-CH(CH3)2) + O2 → Гідроперокисид кумену (C6H5-C(CH3)2-OOH) → Фенол + Ацетон | ||||
| + HNO3 → Нітробензен + 6H→ Анілін | Анілін (C6H5-NH2) | Барвники, ліки | ||
| + H2/Ni → Циклогексан → Капролактам | Капролактам | Синтетичні волокна | ||
| + O2/V2O5 → Малеїнова кислота → Малеїновий ангідрид | Малеїновий ангідрид | Поліестери | ||
| + Етилен (CH2=CH2) → Етилбензен (C6H5-CH2-CH3) + ZnO → Стирен (C6H5-CH=CH2) + H2 | Стирен | Пластмаси, синтетичні каучуки | ||
| + HOSO2Cl → Бензосульфанілхлорид (C6H5-SO2Cl) → Бензосульфаніламід | Бензосульфаніламід | Ліки, барвники | ||
.
Нижче наведено процентне співвідношення використання
- Близько 50 % бензолу перетворюють на етилбензол (алкілювання бензолу етиленом);
- близько 25 % бензолу перетворюють на кумол (алкілювання бензолу пропиленом);
- приблизно 10—15 % бензолу гідрують в циклогексан;
- близько 10 % бензолу витрачається на виробництво нітробензолу;
- 2—3 % бензолу перетворюють на лінійні алкілбензоли;
- приблизно 1 % бензолу використовується для синтезу хлорбензолу.
У суттєво менших кількостях бензол використовується для синтезу деяких інших сполук. Зрідка і в крайніх випадках, через високу токсичність, бензол використовується як розчинник. Крім того, бензол входить до складу бензину. Зважаючи на високу токсичність його зміст новими стандартами обмежена введенням до 5 %.
Гомологи бензену
Бензен, як і інші вуглеводні, утворює свій гомологічний ряд, що має загальну формулу CnH2n-6. Гомологи бензену можна розглядати як продукти заміщення одного або кількох атомів Гідрогену в молекулі бензену різними вуглеводневими радикалами, що утворюють бічні ланцюги.
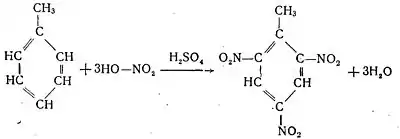
Найпростішим гомологом бензену є метилбензен — продукт заміщення атома водню в молекулі бензену метильною групою — СН3
Метилбензен, що має технічну назву толуен, являє собою безбарвну рідину з характерним запахом. Температура кипіння 110,6 °C. Густина 0,867 г/см³ За своїми хімічними властивостями метилбензен, або толуен, як інші гомологи бензену, дуже близький до бензену. Так, при дії концентрованої нітратної кислоти, в присутності сульфатної кислоти він легко піддається нітруванню з утворенням тринітротолуену — сильно вибухової речовини
Метилбензен (толуен) добувають з кам'яновугільної смоли і коксового газу разом з бензеном, а потім відокремлюють шляхом дробної перегонки. Метилбензен, або толуен застосовують головним чином для виробництва вибухових речовин — тринітротолуену, який називають ще тротилом і толом. Крім того, толуен служить сировиною для виробництва барвників і інших органічних продуктів.
Див. також
Примітки
- Arnold D., Plank C., Erickson E., Pike F. (1958). Solubility of Benzene in Water. Industrial & Engineering Chemistry Chemical & Engineering Data Series 3 (2): 253. doi:10.1021/i460004a016.
- Nagendrappa G. (2001). Benzene and its isomers. How many structures can we draw for C6H6?. Resonance 6: 74–78. doi:10.1007/BF02839086.
- Гордієнко О., Корнілов М., Голуб О., Ісаєв С., Толмачова В., Ковтун О. (2008). Сучасна хімічна термінологія та номенклатура орган. хімії. Вісник Національного університету «Львівська політехніка» 620: 66–9.
- Ластухін Ю.О., Воронов С.А. (2006). Органічна хімія. Львів: Центр Європи. с. 864. ISBN 966-7022-19-6.
- Noe R.C., Bader A. (1993). Facts are better than dreams. Chemistry in Britain: 126–8.
Посилання
Джерела
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
- Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.