Внутрішня енергія
Поняття внутрішня енергія стосується термодинаміки, статистичної фізики, а також фізики суцільних середовищ. Всяка термодинамічна система складається з величезної кількості часток. Енергія руху і взаємодії цих часток називається енергією системи. Повна енергія термодинамічної системи розділяється на зовнішню і внутрішню. Частина енергії, що складається з енергії руху системи як цілого і потенціальної енергії, називається зовнішньою енергією, друга частина — відноситься до внутрішньої енергії. [1]
З позиції молекулярно-кінетичної теорії внутрішня енергія системи вимірюється рівнем кінетичної енергії молекул цього тіла, проте подібні погляди недостатні для пояснення всіх відомих явищ виділення енергії (хімічні , атомно-ядерні реакції, тощо). Питання про істинну природу внутрішньої енергії тіл тісно пов'язане з вивченням будови матерії, що виходить за рамки можливостей першого закону термодинаміки. В основу побудови феноменологічної термодинаміки покладено загальне визначення внутрішньої енергії тіл і систем, яке не обмежує можливостей строгої побудови цієї науки на базі постулатів загальнолюдського досвіду. [2]
З цієї точки зору: Внутрішньою енергією рівноважної термодинамічної системи називається повний запас енергії внутрішнього стану системи, визначуваний залежно від деформаційних координат і температури.
Повний запас енергії внутрішнього стану системи () не мoже вважатись відомим ні на якому рівні розвитку природознавства, проте ця обставина не обмежує рівня спільності і точності математичних виразів основних принципів і розрахункових співвідношень термодинаміки, оскільки в ці співвідношення входять лише величини зміни внутрішньої енергії. [2] Перелік складових частин повної енергії, що входять у внутрішню енергію, непостійний і залежить від вирішуваної задачі. Інакше кажучи, внутрішня енергія — це не специфічний вид енергії, а сукупність тих змінюваних складових частин повної енергії системи, які слід враховувати в конкретній ситуації. [3]
Визначення супутніх понять
- Термодинамічна система — виділена з довкілля макроскопічна частина простору, обмежена реальною або уявною поверхнею розділу. Термодинамічними системами вважають тільки ті макроскопічні системи, що знаходяться в рівноважному стані. [4]
- Макроскопічними параметрами термодинамічної системи називають всі макроскопічні ознаки, що характеризують таку систему в її ставленні до навколишніх тіл. [5]
- Стан термодинамічної системи — сукупність незалежних макроскопічних параметрів, що визначають її властивості. [6]
- Термодинамічний процес — сукупність змін стану термодинамічної системи при переході з одного рівноважного стану в другий. [7]
Історична довідка
Поняття внутрішня енергія ввів у термодинаміку Рудольф Клаузіус (1850) , що не стурбувався привласненням спеціального найменування функції , використаною вченим в математичному формулюванні першого закону термодинаміки.[8] Згодом Клаузіус називав функцію просто енергією. Вільям Томсон (лорд Кельвін) (1851) в статті «Про динамічну теорію теплоти дав цій новій фізичній величині прийняте донині трактування і назву Механічна енергія. Термін внутрішня енергія (internal energy) належить У. Ренкіну.
Властивості внутрішньої енергії
- Внутрішня енергія є скалярна величина, яка не залежить від вибору системи відліку. В її состав не входить кінетична енергія руху і потенційна енергія положення системи як єдиного цілого, а також кінетична
енергія середовища у середині системи (енергія зміщення елементарних областей при деформації твердих тіл і енергія потоків рідин і газів в середовищі).
- Внутрішня енергія є величина аддитивна, тобто внутрішня енергія системи дорівнює сумі внутрішніх енергій її підсистем.
- Внутрішня енергія задається з точністю до постійного доданку, що залежить від обраного нуля відліку (наприклад, °C і 760 мм рт. ст.)
- Внутрішня енергія є функцією стану термодинамічної системи.
На останній властивості ми зупинимося окремо.
Функції стану і функції процесів в термодинаміці
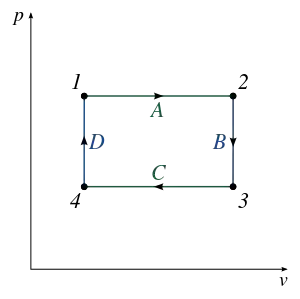
1. Функції змінних величин, які залежать від початкового і кінцевого станів системи і не залежать від шляху процесу, називаються функціями стану. Функції стану — це характеристики, які в кожній точці термодинамічної системи мають цілком певне значення, наприклад: внутрішня енергія, ентальпія, ентропія і так далі. Пояснемо це на прикладі. Візьмемо довільну термодинамічну систему, в якій відбувається деякий круговий термодинамічний процес, зображений на рисунку. Для наочності представимо його графічно в координатах . Під час проходження циклу система отримує теплоту і здійснює роботу . При цьому, відповідно до закону збереження і перетворення енергії, має виконуватися рівність: . Розіб'ємо цикл на дві частини: першу (I)— 1-2-3 і другу (II)— 3-4-1. Пробігаючи першу частину циклу система одержує теплоту і здійснює роботу , а для другої частини циклу маєм, відповідно, і . Згідно рівнянням маєм:
або
Якщо другу частину циклу система проходить в зворотному напрямі, тобто шляхом 1-4-3, знаки теплоти і роботи міняються на зворотні. Тому для двох різних траєкторій переходу системи від стану 1 до стану 3 маємо:
Якщо повторити ці міркування для шляхів I і II і всіляких інших траєкторій, дійдемо висновку, що при будь-якому шляху переходу системи із стану 1 у стан 3 різниця залишається постійною:
Тут — номер шляху. Різницю можна розглядати як зміну деякої функції
Величина показує, на скільки отримана системою теплота більше, ніж виконана нею робота; різниця між цими величинами є енергія, витрачена на зміну енергетичного стану самої системи. Тому функції дали назву внутрішня енергія.
Внутрішня енергія термодинамічної системи включає кінетичну енергію усіх видів руху структурних її часток і потенційну енергію сил взаємодії між ними. Кінетична енергія залежить від температури, а потенційна енергія - від відстані між частками, тобто від займаного системою об'єму, у зв'язку з чим внутрішню енергію зручно виражати у вигляді функції двох змінних: питомого об'єму і температури:
Як було показано вище, зміна внутрішньої енергії при переході системи з стану 1 у стан 2 не залежить від виду процесу переходу і дорівнює різниці рівней значень внутрішніх енергій в цих станах:
З урахуванням того, що , диференціал внутрішньої енергії має вигляд:
А оскільки і температура, і питомий об'єм — параметри стану системи, то і внутрішня енергія є функцією стану і повним диференціалом. [9] (Строгий доказ див. в книзі (рос.) Н.В. Аршава "Функции состояния термодинамических систем и функции термодинамических процессов".
2. Стан системи описується також за допомогою термодинамічних функцій, що не є незалежними від шляху переходу системи з одного стану до другого і не є повними диференціалами, наприклад , теплота і робота . На відміну від функцій стану ці функції називають функціями процесу, або переходу. Теплота є кількість переданої з довкілля енергії в хаотичній формі, а робота є кількість переданої енергії у впорядкованій формі. Відмінність теплоти і роботи від внутрішньої енергії полягає в тому, що внутрішня енергія, є енергією хаотичного руху усіх мікрочасток системи, яка визначається в даний момент часу через власні (внутрішні) величини —(параметри стану), а теплота і робота визначаються не лише через параметри стану, але і через зовнішні (граничні) величини, що характеризують особливості взаємодії системи з довкіллям, тобто характеризують термодинамічний процес. Що стосується зміни (приросту) внутрішньої енергії , то він є повним диференціалом, що однозначно визначається через параметри системи, (наприклад, температуру і об'єм), тоді як елементарні величини теплоти і роботи є часткові (парціальні) прирости енергії системи, які на відміну від повних і частинний приростів, не можуть бути однозначно визначені через параметри системи, і таким чином не є функціями аргументів. Інакше кажучи, відмінність теплоти і роботи як частинних приростів енергії від повного приросту енергії (повного диференціала) полягає в тому, що повний приріст енергії залежить лише від значень енергії у початковому і кінцевому станах системи, а часткові прирости енергії (теплота і робота) залежать не лише від початкового і кінцевого стану, але і від співвідношення (відносної долі) цих величин в повній зміні енергії, тобто від процесу. Проте, якщо процес заданий і звісна доля теплоти і роботи, то вона більше не є змінною величиною, що визначає процес, і тоді теплота і робота , як і внутрішня енергія, будуть функціями стану системи.
6. Зміна стану термодинамічної системи.
При побудові термодинаміки приймається, що всі можливі енергетичні взаємодії між тілами зводяться лише до передачі теплоти і роботи. У процесах зміни стану термодинамічної системи відбувається обмін енергією з довкіллям у вигляді передачі певної кількості теплоти або роботи, в результаті чого внутрішня енергія системи змінюється. У незамкнутому процесі, при будь-якій зміні стану системи від вихідного стану 1 до деякого кінцевого стану 2, різниця між отриманою кількістю теплоти і виконаною системою роботою має одне і те ж значення, незалежно від шляху переходу зі стану 1 в стан 2.
У круговому процесі, при поверненні системи з любого стану до вихідного, усі параметри системи, які є функціями стану, отримують первісне значення. Згідно з першим законом термодинаміки, при будь-якому круговому процесі зміни термодинамічної системи, різниця між отриманою системою кількістю теплоти і здійсненою нею роботою дорівнює нулю.
або в інтегральному вигляді:
Експериментальне визначення внутрішньої енергії
У рамках термодинаміки абсолютне значення внутрішньої енергії знайдене бути не може, оскільки вона задається з точністю до аддитивної постійної. Експериментально можна визначити зміну внутрішньої енергії, а невизначеність, обумовлену аддитивною постійною, усунути вибором стандартного стану у якості стану відліку[10]. З наближенням температури до абсолютного нуля внутрішня енергія стає незалежною від температури і наближається до певного постійного значення, яке може бути прийняте за початок відліку внутрішньої енергії. З метрологічної точки зору знаходження зміни внутрішньої енергії є непрямий вимір, оскільки цю зміну визначають за результатами прямих вимірів інших фізичних величин, функціонально пов'язаних зі зміною внутрішньої енергії.
Внутрішня енергія фотонного газу
У термодинаміці рівноважне теплове випромінювання розглядають як фотонний газ, що заповнює об`єм. Внутрішня енергія такої системи безмасових частинок, що дається законом Стефана─ Больцмана, дорівнює [11]:
,
де — постійна Стефана-Больцмана, — електродинамічна постійна (швидкість світла у вакуумі). З цього виразу випливає, що внутрішня енергія фотонного газу адитивна за об'ємом.
Канонічне рівняння стану для внутрішньої енергії фотонного газу має вигляд: [12]
| (Канонічне рівняння стану для внутрішньої енергії фотонного газу) |
Внутрішня енергія, як термодинамічний потенціал
Оскільки внутрішня енергія є функцією стану, то її можна визначити як термодинамічний потенціал, залежний від об'єму, числа частинок у системі, та ентропії:
Для квазістатичних процесів виконується співвідношення:
де —температура, — ентропія, — тиск, — хімічний потенціал,— кількість частинок у системі.
Примітки
- Базаров И.П., 2010, с. 24─25.
- Белоконь Н.И., 1968, с. 32─33.
- Герасимов Я.И. и др., 1964, с. 31.
- Агеев Е.П., 2005, с. 20.
- Базаров И.П., 2010, с. 14.
- Базаров И.П., 2010, с. 15.
- Нащокин В.В., 1975, с. 15.
- Кричевский И. Р., 1970, с. 126.
- Аршава Н.В., 2006, с. 38—39.
- Химическая энциклопедия, т.4, 1995, с. 413.
- Гуггенгейм, Современная термодинамика.
- Базаров И.П., 2010, с. 157.
Джерела
- Агеев Е.П. Неравновесная термодинамика. — 2-е изд. — М. : МЦНМО, 2005. — 160 с. — ISBN 5-94057-191-3.
- Аршава Н.В. Функции состояния термодинамических систем и функции термодинамических процессов. — 2-е изд. — Ухта : УГТУ, 2006. — 79 с. — ISBN 5-88179-298-Х.
- Базаров И.П. Термодинамика. — 5-е. — СПб.—М.—Краснодар : Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература) — ISBN 978-5-8114-1003-3.
- Белоконь Н.И. Основные принципы термодинамики. — М. : Недра, 1968. — 112 с.
- Герасимов Я.И. и др. Курс физической химии. — М.—Л. : "Химия", 1964. — Т. 1. — 624 с.
- Гуггенгейм. Современная термодинамика, изложенная по методу У. Гиббса / Пер. под ред. проф. С. А. Щукарева. — Л.—М. : Госхимиздат. — 188 с.
- Кричевский И. Р. Понятия и основы термодинамики. — 2-е изд. — М. : Химия, 1970. — 440 с.
- Нащокин В.В. Техническая термодинамика и теплопередача. — 2-е изд. — М. : "Высшая школа", 1975. — 496 с.
- Химическая энциклопедия / Гл. ред. Н. С. Зефиров. — М., 1995. — Т. 4. — 640 с. — ISBN 5-85270-092-4.
