Водневий електрод
Водне́вий електро́д — окисно-відновний електрод, що береться за основу термодинамічної шкали окисно-відновних потенціалів. Для порівняння з потенціалами інших електродів потенціал стандартного водневого електроду вважається нульовим незалежно від температури.
Водневий електрод називають стандартним при тиску водню 1 атм та активності катіонів водню в розчині 1 моль/л.
Абсолютний електродний потенціал стандартного водневого електроду оцінюється в 4,44 ± 0,02 В при 25 °C.
Загальний опис
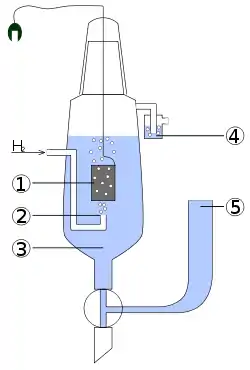
1 — платиновий електрод
2 — подача водню
3 — кислотний розчин з a(H+)=1 моль/л
4 — запобіжник від проникнення кисню
5 — резервуар
Благородні метали, наприклад, золото, платина та деякі інші, мають міцну кристалічну ґратку і їх катіони не переходять в розчин з металу. Такі метали не мають на межі метал—розчин характерного стрибку потенціалу. Однак, якщо на поверхні металу сорбована речовина, здатна окиснюватися чи відновлюватися, — це вже система, в якій може формуватися подвійний електричний шар і можливий перебіг окисно-відновних процесів.
У водневому електроді як інертний метал використовують платину, на поверхні якої адсорбується газуватий водень. Для збільшення адсорбуючої поверхні й зниження перенапруги платину електролітично покривають шаром тонкодисперсної платини (платиновою черню). Водневий електрод оборотний стосовно йона водню, отже, є електродом першого роду.
Напівреакція і потенціал електроду
На поверхні водневого електроду встановлюються рівноваги:
- H2(г) ⇄ H2(пов) ⇄ 2H(пов) ⇄ 2H+(р) + 2e-
В результаті цих процесів на межі між платиною та розчином іонів водню утворюється подвійний електричний шар, що спричиняє стрибок потенціалу. Величина цього потенціалу при даній температурі залежить від активності водневих іонів в розчині та кількості поглинутого платиною водню, яка пропорційна його тиску. Рівняння Нернста для цієї системи запишеться так:
або після простих алгебраїчних перетворень:
де
- — активність катіонів водню в розчині
- pH — водневий показник
- — парціальний тиск водню й стандартний тиск (1 атм) відповідно
- R — універсальна газова стала
- F — стала Фарадея
- T — термодинамічна температура
Джерела
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0