Водень
Вóдень (гідроге́н[7], гідроґе́н[8]; хімічний символ — H, лат. Hydrogenium) — хімічний елемент з атомним номером 1, який належить до 1-ї групи (за старою класифікацією — головної підгрупи 1-ї групи), 1-го періоду періодичної системи хімічних елементів, та є першим і найпростішим представником усіх хімічних елементів взагалі. Найбільш розповсюджений елемент Всесвіту. Належить до неметалів.
| 1 | Водень |
1,0079 | |
| 1s1 | |
Також, вóдень (H2) — проста речовина, яку утворює хімічний елемент водень — (за нормальних умов) дуже легкий (найлегший), двоатомний газ без запаху, кольору та смаку.
Водень погано розчиняється у воді та інших розчинниках (спирт, гексан), добре — у багатьох металах, найкраще в паладії (в одному об'ємі паладію розчиняється вісім об'ємів водню). Водень входить до багатьох природних сполук, найважливіша з яких — вода. Сполуки з неметалами та металами називаються гідридами. Суміш водню з киснем (гримучий газ) вибухонебезпечна. Водень є відновником. Сировина для промислового отримання водню — гази нафтопереробки, гази природні, продукти газифікації вугілля та вода. Основний лабораторний спосіб отримання водню — взаємодія цинку та соляної кислоти в апараті Кіпа. Водень застосовують для синтезу аміаку, метилового спирту, в процесах гідрогенізації, при зварюванні й різанні металів тощо. Водень — перспективне газоподібне пальне.
Три ізотопи гідрогену мають власні назви: 1H — протій (Н), 2H — дейтерій (D) і 3H — тритій (T). Дейтерій і тритій використовують в атомній енергетиці.
Історія
Виділення горючого газу при взаємодії кислот та металів спостерігали у XVI та XVII століттях на початку становлення хімії як науки, такі вчені як, наприклад, Парацельс чи Роберт Бойль. У своїй дисертації «О металлическом блеске» Михайло Ломоносов описав отримання водню в результаті дії кислот на залізо та інші метали, і першим (1745) висунув гіпотезу про те, що водень являє собою флогістон. 1766 року і відомий англійський фізик та хімік Генрі Кавендіш, який докладним чином вивчив властивості водню, висунув подібну ж гіпотезу. Досліджуючи, як при спаленні водень давав воду, він називав його «горючим повітрям», отриманим з «металів», і вважав, як і всі флогістики, що при розчиненні в кислотах метал втрачає свій флогістон. Дотримання Кавендішом теорії флогістону завадило йому зробити правильні висновки. Французький хімік Антуан Лавуазьє разом із інженером Жаном Меньє, використовуючи спеціальні газометри, у 1783 році здійснили синтез води, а згодом її аналіз, розклавши водяну пару розжареним залізом. Таким чином вони встановили, що водень входить до складу води (H2O) та може бути отриманий із неї. Ізотопи водню було відкрито в 30-x роках XX століття й вони швидко набули великого значення в науці й техніці. Наприкінці 1931 Юрі Брекуедд і Мерфі досліджували залишок після тривалого випарювання рідкого водню і виявили в ньому важкий водень 2Н з атомною масою 2. Цей ізотоп назвали дейтерієм (Deuterium, D) від грец. — другий. Через чотири роки у воді, підданій тривалому електролізу, було виявлено ще важчий ізотоп водню 3Н, який назвали тритієм (Tritium, Т), від грец. «третій».
Походження назви
А. Лавуазьє дав назву «hydrogene» (від грец. ὕδωρ — вода та γενναω — народжую) — «той, що народжує воду». 1801 року послідовник А. Л. Лавуазьє академік В. М. Севергін називав його «водотворна речовина», він писав[9]:
«Водотворна речовина в поєднанні з киснетворною складають воду. Це можна довести, як через розкладання, так і через складання»
. Традиційна українська назва хімічного елементу «водень» також вказує на входження його до складу води. Російська назва «водород» — дослівний переклад латинської назви hydrogenium.
Поширення
У Всесвіті

Водень — найпоширеніший хімічний елемент у Всесвіті[10]. На його частку припадає близько 88,6 % всіх атомів (близько 11,3 % складають атоми гелію, частка всіх інших разом узятих елементів — приблизно 0,1 %)[11]. Таким чином, водень — основна складова частина зір та міжзоряного газу. В умовах зоряних температур (наприклад, температура поверхні Сонця ≈ 6000 °C) водень існує у вигляді плазми, в міжзоряному просторі цей елемент існує у вигляді окремих молекул, атомів та іонів і може утворювати молекулярні хмари, які значно різняться між собою за розмірами, щільністю й температурою.
Земна кора та живі організми
У земній корі водню міститься близько 1 % за масою — це десятий за масовою поширеністю елемент. Однак його роль в природі визначається не масою, а числом атомів, частка яких серед інших елементів становить 17,25 % (друге місце після кисню, частка атомів якого дорівнює ≈ 52 %). Тому значення водню в хімічних процесах, що відбуваються на Землі, майже таке велике, як і кисню. На відміну від кисню, що існує на Землі і у зв'язаному, й у вільному станах, практично весь водень на Землі перебуває у вигляді сполук; лише в дуже незначній кількості водень у вигляді простої речовини міститься в атмосфері. Відносний вміст водню в атмосфері збільшується з висотою. На рівні моря він становить 0,00005 % за об'ємом[12][13], верхні ж шари (вище 100 км) складаються в основному з нього. Вільний водень міститься в горючих газах, що виділяються із надр землі. Він утворюється при гнитті й бродінні органічних речовин і тому міститься в кишкових газах людини й тварин. Основна маса Гідрогену перебуває в зв'язаному стані у вигляді різноманітних сполук. Найпоширенішими з них є вода, до складу якої входить 11,19 % Гідрогену. Відома велика кількість сполук Гідрогену з вуглецем (вуглеводні). Гідроген входить до складу нафти, кам'яного вугілля, деяких мінералів. Водень входить до складу практично всіх органічних речовин і наявний у всіх живих клітинах. У живих клітинах за кількістю атомів на водень припадає майже 63 %[14].
Геохімія
На Землі вміст водню знижений в порівнянні із Сонцем, планетами-гігантами й первинними метеоритами, з чого випливає, що під час утворення Земля була значно дегазована: основна маса водню, як і інших летючих елементів, залишила планету під час акреції або незабаром після неї. Однак точний вміст даного газу в складі геосфер нашої планети (виключаючи земну кору) — астеносфери, мантії, ядра Землі — невідомо.
Вільний водень H2 відносно рідко зустрічається в земних газах, але у вигляді води він бере виключно важливу участь в геохімічних процесах. Відомо вміст водню в складі вулканічних газів, витікання деяких кількостей водню вздовж розломів в зонах рифтогенезу, виділення цього газу в деяких вугільних родовищах[15][16]. До складу мінералів водень може входити у вигляді іона амонію, гідроксил-іона і води.
В атмосфері молекулярний водень безперервно утворюється в результаті розкладання формальдегіду, що утворюється в ланцюжку окислення метану або іншої органіки, сонячним випромінюванням (31-67×109 кг/рік), неповного згоряння різних палив і біомас (по 5-25×109 кг/рік), в процесі фіксації азоту мікроорганізмами з повітря (3-22×109 кг/рік).[17][18][19].
Маючи малу масу, молекули водню мають високу швидкість дифузійного руху (вона близька до другої космічної швидкості) і, потрапляючи у верхні шари атмосфери, можуть полетіти в космічний простір (див. планетарний вітер). Обсяги втрат оцінюються в 3 кг в секунду[20][21].
Ізотопи


Гідроген трапляється у вигляді трьох ізотопів, які мають індивідуальні назви: 1H — протій (Н), 2Н — дейтерій (D), 3Н — тритій (радіоактивний) (T).
Протій і дейтерій є стабільними ізотопами з масовими числами 1 і 2. Вміст їх у природі відповідно становить 99,9885 ± 0,0070 % і 0,0115 ± 0,0070 %[22]. Це співвідношення може незначно змінюватися залежно від джерела та способу отримання водню.
Ізотоп водню 3Н (тритій) нестабільний. Його період напіврозпаду становить 12,32 років[22]. Тритій міститься в природі в дуже малих кількостях. У літературі[22] також наводяться дані про ізотопи водню з масовими числами 4-7 і періодами напіврозпаду 10−22—10−23 с.
Природний водень складається з молекул H2 і HD (дейтероводень) у співвідношенні 3200:1. Вміст чистого дейтерійного водню D2 ще менший. Відношення концентрацій HD і D2 приблизно 6400:1.
Серед ізотопів усіх хімічних елементів фізичні й хімічні властивості ізотопів водню відрізняються один від одного найсильніше. Це пов'язано з найбільшою відносною зміною мас атомів[23].
| Температура плавлення, K | Температура кипіння, K | Потрійна точка, K / кПа | Критична точка, K / кПа | Густина рідкий / газ, кг/м³ | |
|---|---|---|---|---|---|
| H2 | 13,96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| HD | 16,65 | 22,13 | 16,60 / 12,8 | 35,91 / 1,48 | 114,80 / 1,802 |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,310 | |
| D2 | 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,230 |
| DT | 24,38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Молекулярній водень, якщо обидва атоми в молекулі є однаковими (протій, дейтерій або тритій), тобто якщо молекула є гомоізотопною, може існувати в орто- і парамодіфікації, що відрізняються напрямком спінів ядер — в ортомодифікації спіни ядер паралельні, в парамодифікації антипаралельні (див. нижче). Гетероізотопний водень (HD, HT, DT) не має орто- і парамодифікацій.
Властивості ізотопів
Властивості ізотопів водню подано в таблиці[22][24][25].
| Ізотоп | Z | N | Маса, а. о. м. | Період напіврозпаду | Спін | Вміст у природі, % | Тип та енергія розпаду | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабільний | 1⁄2+ | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабільний | 1+ | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) роки | 1⁄2+ | β− | 18,591(1) кеВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)×10−22 с | 2− | -n | 23,48(10) МеВ | |
| 5H | 1 | 4 | 5,035 31(11) | понад 9,1−22 с | (1⁄2+) | -nn | 21,51(11) МеВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)−22 с | 2− | −3n | 24,27(26) МеВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)−23 с | 1⁄2+ | -nn | 23,03(101) МеВ | |
В круглих дужках наведено середньоквадратичне відхилення значення в одиницях останнього розряду відповідного числа.
Властивості ядра 1H дозволяють широко використовувати ЯМР-спектроскопію в аналізі органічних речовин.
Фізичні властивості

Водень — найлегший газ, він легший за повітря в 14,5 разів. Тому, наприклад, мильні бульбашки, наповнені воднем, у повітрі здіймаються вгору[26]. Очевидно, що чим менше маса молекул, тим вище їх швидкість при одній і тій же температурі. Як найлегші, молекули водню рухаються швидше молекул будь-якого іншого газу і тим самим швидше можуть передавати теплоту від одного тіла до іншого. Звідси випливає, що водень має найвищу теплопровідність серед газоподібних речовин. Його теплопровідність приблизно в сім разів вище теплопровідності повітря.
Молекула водню складається з двох атомів водню — Н2. За нормальних умов, водень — це газ без кольору, запаху й смаку з густиною 0,08987 г/л (н.у.), температурою кипіння −252,76 °C, теплота згоряння 142,9 кДж/кг. Водень малорозчинний у воді — 18,8 мл/л. Але він добре розчиняється у багатьох металах (Ni, Pt, Pd тощо), особливо в паладії (850 об'ємів на 1 об'єм Pd). З розчинністю водню в металах пов'язана його здатність дифундувати через них; дифузія через вуглецевий сплав (наприклад, сталь) іноді супроводжується руйнуванням сплаву внаслідок взаємодії водню з вуглецем (так звана декарбонізація). Практично не розчинний у сріблі.
Рідкий водень існує в дуже вузькому інтервалі температур від −252,76 до −259,2 °C. Це безбарвна рідина, дуже легка (густина при −253 °C — 0,0708 г/см³) й текуча (в'язкість при −253 °C — 13,8 пуаз). Критичні параметри водню дуже низькі: температура −240,2 °C і тиск 12,8 атм. Цим пояснюються труднощі при зрідженні водню. У рідкому стані рівноважний водень складається з 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердий водень має температуру плавлення −259,2 °C, густину 0,0807 г/см³ (при −262 °C) — білосніжна маса з кристалами гексагональної сингонії, просторова група — P6/mmc, з параметри комірки a = 0,378 нм і c = 0,6167 нм. У 1935 році Уінгер і Хунтінгтон висловили припущення про те, що при тиску понад 250 тисяч атм водень може перейти в металевий стан. Отримання цієї речовини в стійкому стані відкривало дуже привабливі перспективи його застосування — адже це був би надлегкий метал, компонент легкого і енергомісткого ракетного палива. 2014 року було встановлено, що за тиску порядку 1,5—2,0 млн атм водень починає поглинати інфрачервоне випромінювання, а це означає, що електронні оболонки молекул водню поляризуються. Можливо, за вищого тиску водень перетвориться в метал[27].
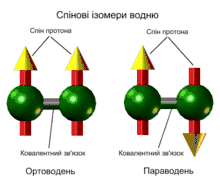
Орто- і параводень
Молекулярний водень існує в двох спінових формах (модифікаціях) — у вигляді орто- і параводню. У молекулі ортоводню o-H2 (температура плавлення −259,10 °C, температура кипіння −252,56 °C) ядерні спіни спрямовані однаково (паралельно), а у параводню п-H2 (температура плавлення −259,32 °C, температура кипіння −252,89 °C) — протилежно один до одного (антипаралельно). Рівноважна суміш o-H2 і п-H2 при заданій температурі називається рівноважний водень e-H2.
- орто-H2 ⇆ пара-H2 ΔH0R = −0,08 кДж/моль
Перехід з одної у другу форму відбувається відповідно при зміні енергії у системі (відводі чи додаванні).
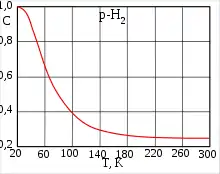
Розділити алотропні модифікації водню можна адсорбцією на активованому вугіллі при температурі рідкого азоту. При дуже низьких температурах рівновага між ортоводнем і параводнем сильно зміщується в бік пара. У рідкому стані рівноважний водень складається з 99,79 % пара-Н2 і 0,21 % орто-Н2. При 80 К співвідношення форм приблизно 1:1. Десорбований параводень при нагріванні перетворюється в ортоводень аж до утворення рівноважної при кімнатній температурі суміші (орто: пара = 75:25). Без каталізатора перетворення відбувається повільно (в умовах міжзоряного середовища — з характерними часами аж до космологічних), що дає можливість вивчити властивості окремих модифікацій.
Молекули дейтерію і тритію також мають орто- і пара-модифікації: p-D2, o-D2, p-T2, o-T2, залежно від орієнтації спінів ядер. Гетероізотопні молекули HD, HT, DT не мають орто-і пара-модифікацій.
Характеристики молекули водню
Міжатомні відстані та енергії дисоціації молекул водню, його ізотопів і молекулярного йона водню:
| Молекула | Міжатомна відстань, Å | Енергія дисоціації, еВ |
|---|---|---|
| H2 | 0,7416 | 4,477 |
| HD | 0,7414 | 4,512 |
| D2 | 0,7416 | 4,555 |
| DT | 0,7416 | 4,570 |
| T2 | 0,7416 | 4,588 |
| HT | 0,7416 | 4,524 |
| H+2 | 1,06 | 2,648 |
Константи реакції дисоціації молекулярного водню (Kp) і ступінь перетворення (α) в залежності від абсолютної температури:
| T, К | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10−6 | 2,47 · 10−2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10−4 | 7,83 · 10−2 | 0,621 | 0,954 | 0,992 | 0,999 |
Хімічні властивості

Молекула водню складається із двох атомів. Хімічний зв'язок у молекулі водню — ковалентний неполярний, оскільки молекула утворена атомами з однаковою електронегативністю (атомами одного виду). Через спільнення електронів молекула водню енергетично стійкіша, ніж атоми водню окремо. При нормальних умовах водень мало активний. Енергія дисоціації 436 кДж/моль, тому для активації реакційних властивостей потрібна активація молекули — підвищення температури, електрична іскра, світло (витрата значної кількості енергії):
- — 432 кДж
Взаємодія з неметалами
Найактивніше реагує з галогенами утворює галогеноводні:
- , реакція протікає із вибухом за будь-якої температури,
- , реакція протікає тільки на світлі.
При підпалюванні чи в присутності платинового каталізатора водень реагує із киснем
- , реакція протікає із вибухом.
Суміш двох об'ємів водню та одного об'єму кисню називається гримучим газом.
При нагріванні водень зворотно взаємодіє із сіркою :
З азотом — при нагріванні, підвищенні тиску та у присутності каталізатору (залізо):
- (аміак)
Із сажею водень взаємодіє при сильному нагріванні:
- (метан)
Взаємодія із лужними та лужноземельними металами
Водень утворює із активними металами гідриди:
Гідриди металів — солеподібні, тверді речовини, легко гідролізуються:
Взаємодія з оксидами неметалів (як правило, оксидами азоту та вуглецю)
Водень є компонентом синтез-газу при отриманні метилового спирту
- (метанол)
Гідрування органічних сполук
Молекулярний водень широко застосовується в органічному синтезі для відновлення органічних сполук. Ці процеси називають реакціями гідрування. Ці реакції проводять у присутності каталізатора при підвищених тиску й температурі. Каталізатор може бути як гомогенним (напр., каталізатор Вілкінсона), так і гетерогенним (напр., нікель Ренея, паладій на вугіллі).
Так, зокрема, при каталітичному гідруванні ненасичених сполук, таких, як алкени і алкіни, утворюються насичені сполуки — алкани.
При дії водню на ненасичені вуглеводні у присутності нікелевого каталізатора та при підвищеній температурі, відбувається реакція гідрування:
Отримання
Сьогодні водень отримують головним чином (90 %) із викопних джерел[28]. Зв'язок централізованого виробництва з депо малотоннажних автомобілів на паливних елементах потребуватиме розміщення та будівництва розподільчої інфраструктури з великим вкладенням капіталу. Одне із завдань водневої енергетики — забезпечення компактного та безпечного зберігання водню на борту транспортного засобу, з метою подовжити інтервал між заправками.
У промисловості
- з природного газу, що складається в основному з метану, який змішують з водяною парою та киснем і нагрівають до температури 800—900 °C в присутності каталізатора:
- Конверсія з водяною парою при 1000 °C:
- Пропущення пари води над розпеченим коксом при температурі близько 1000 °C:
- при електролізі розчинів хлориду натрію та хлориду калію як побічний продукт виробництва лугів, гіпохлоритів і хлоратів:
- Каталітичне окислення киснем:
Методи виробництва
На Землі у звичайних природних умовах молекулярний водень майже не зустрічається. Більшість водню на Землі зв'язана з киснем у воді. Виробництво елементарного водню вимагає переробки носія водню, наприклад, викопного палива і води. Витрачаються викопні ресурси та виділяється вуглекислий газ, але найчастіше подальший вклад енергії, крім викопного палива, уже не потрібний. Розкладання води вимагає витрат електроенергії або тепла, одержаного з будь-якого первинного джерела енергії (спалення викопного палива, атомної енергії або відновлюваних джерел енергії).
Сучасні методи виробництва

У промисловості водень виробляється через перетворення пари, з використанням викопних видів палива, наприклад, природного газу, нафти чи вугілля[29]. Енергоємність виробленого водню менше, ніж енергія, що міститься у вихідному паливі, але завдяки високому ККД паливних елементів вона може бути використана повніше, ніж при безпосередньому використанню вихідного палива. Внаслідок перетворення вихідного палива, в атмосферу може викидатися вуглекислий газ, так само як внаслідок роботи двигуна автомобіля. Але завдяки високому ККД паливних елементів його кількість може бути меншою, ніж при використанні палива безпосередньо.
Невелика частина водню (4 % в 2006 році) отримується шляхом електролізу води. Для одержання кілограму водню таким шляхом необхідно витратити приблизно 50 кіловат-годин електроенергії.
Процес Кварнера
Кварнер-процес, або кварнер сажі та водню (CB & H)[28] — це метод, розроблений в 1980-х роках однойменною норвезькою компанією для виробництва водню з вуглеводнів, наприклад, з метану, природного газу і біогазу. Розподіл енергії у речовині під час процесу приблизно такий: близько 48 % енергії міститься в атомі водню, 40 % — у вуглеці та 10 % — у перегрітій парі[30].
Біологічне виробництво
Ферментативне виробництво водню — це ферментативне перетворення органічного субстрату в біоводень, що здійснюється групою бактерій за допомогою мультиферментативних систем в три кроки, аналогічно до анаеробного перетворення. Темнова ферментація не потребує світлової енергії, тому можливе неперервне виробництво водню з органічних сполук — вдень і вночі. Фотоферментація відрізняється від темнової ферментації тим, що вона протікає лише за наявності світла. Наприклад, фотоферментація з Rhodobacter sphaeroides SH2C може бути використана для перетворення нижчих жирних кислот у водень[31]. Електрогідрогенезис використовується в мікробних паливних елементах, де водень виробляється з органічних речовин (наприклад, зі стічних вод або твердих речовин[32]) при напрузі 0,2 — 0,8 V.
Біоводень може вироблятися у біореакторі, що містить водорості. Наприкінці 1990-х років було виявлено, що якщо з водоростей вилучити сірку, вони вироблятимуть водень замість кисню, як під час звичайного фотосинтезу.
Біоводень може вироблятись в біореакторах, які використовують іншу сировину, найчастіше цією сировиною є відходи. Цей процес здійснюється бактеріями, що поглинають вуглеводні та виділяють водень і вуглекислий газ. Є кілька способів подальшого відділення CO2, в результаті чого залишається лише водень. Прототип водневого біореактора на відходах введено в експлуатацію на заводі виноградних соків Велч у штаті Пенсільванія.
Електроліз з біокаталізаторами
Крім звичайного електролізу, можливий також електроліз з використанням мікробів. При електролізі з біокаталізаторами водень утворюється внаслідок проходження через мікробний паливний елемент, також можуть використовуватись різноманітні водні рослини. До них належать родини Glyceria, Spartina, рис, помідори, люпин, водорості[33].
Електроліз води
Водень може вироблятись електролізом за високого тиску або електролізом води за низького тиску. У сучасних ринкових умовах 50 кВт·год електроенергії, витраченої на виробництво одного кілограма стисненого водню, коштують приблизно стільки ж, скільки водень, вироблений за 8 центів/(кВт·год). Ціновий еквівалент пояснюється тим, що більшість водню виробляється з викопних видів палива, які ефективніше використовувати для виробництва хімічного продукту безпосередньо, ніж для виробництва електроенергії і подальшого електролізу. Так чи інакше, головним завданням водневої енергетики є отримання водню з інших джерел, тож в майбутньому планується не використовувати викопне паливо як сировину[34].
Електроліз за високого тиску
Електроліз за високого тиску — це електроліз води, при якому вода (H2O) розкладається на кисень (O2) і водень (H2) внаслідок пропускання електричного струму через воду. Різниця між таким електролізером і звичайним полягає у тому, що водень виводиться під тиском близько 120—200 бар[35]. При стисканні водню в електролізаторі потреба у зовнішньому компресорі водню зникає, середнє споживання енергії внутрішнім компресором становить близько 3 %.
Електроліз за високих температур
Водень може бути отриманий в процесі високотемпературного електролізу (HTE), що забезпечується енергією у вигляді тепла та електроенергії. Оскільки частина енергії в HTE — теплова, менша кількість енергії потребує подвійного перетворення (з тепла в електрику, а потім — у хімічну форму), тому на виробництво кілограму водню витрачається набагато менше енергії.
У той час як атомна електроенергія може бути використана для електролізу, теплова ядерна енергія може застосовуватись безпосередньо для розщеплення води на кисень і водень. Розігрітий до високих температур (950—1000 °С) газ у ядерному реакторі може розкладати воду на кисень і водень термохімічним шляхом через використання ядерної теплової енергії. Дослідження можливостей високотемпературних ядерних реакторів можуть зрештою привести до організації виробництва водню, яке буде конкурентоспроможним з виробництвом, що базується на перетворенні природного газу. General Atomics передбачає, що водень, вироблений у високотемпературному газовому реакторі (ВТГР) коштуватиме $ 1.53/кг. У 2003 році водень, одержаний переробкою природного газу, коштував $ 1.40/кг. В перерахунку на вартість природного газу у 2005 році, водень коштує $ 2.70/кг.
Високотемпературний електроліз проводився в лабораторії, з витратами 108 МДж теплової енергії на кілограм водню[36], але не в промислових масштабах. Крім того, в результаті цих процесів одержується низькоякісний «промисловий» водень, який є непридатним для використання в паливних елементах[37].
Фотоелектрохімічне розщеплення води
Найчистішим способом отримання водню є той, що базується на використанні електроенергії, виробленої фотоелектричними системами. Вода розкладається на водень і кисень шляхом електролізу — фотоелектрохімічного (PEC) процесу, який також називають штучним фотосинтезом. У фотоелектричній промисловості ведуться наукові дослідження, спрямовані на розвиток високоефективної технології мультиперехідних елементів.
Концентрація теплової сонячної енергії
Для розкладання води на кисень і водень необхідні дуже високі температури. Щоб процес протікав за нижчих температур, необхідний каталізатор. Нагрівання води може відбуватись за рахунок концентрації сонячної енергії. Hydrosol-2 — це 100 кіловатний експериментальний завод на Plataforma Solar de Almería в Іспанії, який нагріває воду до необхідних 800—1200 ° С за допомогою сонячного світла. Hydrosol II введений в експлуатацію з 2008 року. Розробка цього 100 кіловатного експериментального заводу базується на модульній концепції. Отже, цілком можливо, що діапазон дії цієї технології буде розширений до мегават шляхом збільшення кількості реакторних блоків і з'єднання заводу з геліостатними полями (поля дзеркал, що автоматично орієнтуються на сонце) відповідного розміру[38].
Фотоелектрокаталітичне виробництво
Метод, вивчений Томасом Нанном і його командою в Університеті Східної Англії, складається з золотого електрода, вкритого шарами наночасток фосфіду індія (InP). Вони ввели залізо-сірчаний комплекс в шари покриття, внаслідок чого після занурення у воду і опромінення світлом під невеликим електричним струмом, вироблявся водень з ККД 60 %[39].
Термохімічне виробництво
Є більш ніж 352[40] термохімічних цикли, які можуть використовуватись для розкладання води[41]. Близько десятка з них (наприклад, цикл оксиду заліза, цикл церій (IV) — церій (III) оксид, цикл цинк — цинк-оксид, сульфур-йодний цикл, мідно-хлорний і гібридний сульфурний цикл) зараз досліджуються і знаходяться на фазі випробування з метою одержання водню і кисню з води за допомогою теплової енергії та без використання електрики[42]. Ці процеси можуть бути ефективнішими, ніж електроліз за високих температур, діапазоні ефективності від 35 % — 49 % LHV. Термохімічне виробництво водню з використанням хімічної енергії вугілля або природного газу, як правило, не розглядається, бо безпосередньо хімічний спосіб є ефективнішим.
Жоден з термохімічних процесів виробництва водню не був використаний на промисловому рівні, хоча деякі з них були продемонстровані в лабораторії.
Основний промисловий спосіб отримання водню — реакція метану, який входить до складу природного газу, з водою. Вона проводиться при високій температурі:
Застосування
.jpg.webp) |
| Паливо |
| Фізичні основи |
|
Сонце · Сонячна радіація |
| Викопне паливо |
|
Вугілля · Горючі сланці · Гідрат метану · Нафта · Природний газ · Торф |
| Природне невикопне паливо |
|
Водорості · Деревина · Рослинні і тваринні жири та олії · Трава |
| Штучне паливо |
|
Біопаливо · Генераторні гази · Кокс · Моторні палива |
| Концепції |
|
Енергетична біосировина |
Атомарний водень використовується для атомно-водневого зварювання.
Паливо

Рідкий водень застосовується як ракетне паливо та як охолоджувач, оскільки має найвищу теплопровідність з усіх газів.
Ведуться дослідження по застосуванню водню як палива для легкових і вантажних автомобілів. Водневі двигуни не забруднюють навколишнє середовище і виділяють тільки водяну пару. Перспективним напрямком є використання рідкого водню як палива для двигунів нового типу, так званих паливних елементів. У США та в Європі вже існують водневі заправні станції, які забезпечують воднем автомобілі та автобуси, що на ньому працюють. Ця галузь називається воднева енергетика. У воднево-кисневих паливних елементах використовується водень для безпосереднього перетворення енергії хімічної реакції на електричну.
Хімічна промисловість
Водень використовується при виробництві метанолу, мила і пластмас, при синтезі аміаку NH3, хлороводню HCl, метанолу СН3ОН, при гідрокрекінгу (крекінг у атмосфері водню) природних вуглеводнів, як відновник при отриманні деяких металів.
Харчова промисловість
- Гідруванням природних рослинних олій отримують твердий жир — маргарин.
- Зареєстрований як харчова добавка E949 (упакувальний газ, клас «інші»). Входить у список харчових добавок, які допускаються до застосування в харчовій промисловості як допоміжний засіб для виробництва харчової продукції.
Авіаційна промисловість
Водень дуже легкий і в повітрі завжди піднімається вгору. Колись дирижаблі та повітряні кулі наповнювали воднем. Але у 30-х рр. XX ст. відбулося декілька катастроф, під час яких дирижаблі вибухали і згорали. В наш час дирижаблі наповнюють гелієм, попри його значно більшу вартість.
Метеорологія
Використовується в метеорології для заповнення кулепілотних оболонок.
Запобіжні заходи

Водень при змішуванні з повітрям утворює вибухонебезпечну суміш — так званий гримучий газ. Найбільшу вибухонебезпечність цей газ має при об'ємному відношенні водню і кисню 2:1, або водню та повітря приблизно 2:5, оскільки в повітрі міститься приблизно 21 % кисню. Також водень пожежонебезпечний. Рідкий водень при потраплянні на шкіру може викликати сильне обмороження.
Вважається, що вибухонебезпечні концентрації водню з киснем містять від 4 до 96 % об'ємних та при суміші з повітрям від 4 % до 75 (74)% за об'ємом. Такі цифри фігурують зараз у більшості довідників, і ними цілком можна користуватися для орієнтовних оцінок. Проте слід мати на увазі, що більш пізні дослідження (приблизно кінець 80-х) виявили, що водень у великих обсягах може бути вибухонебезпечний і при меншій концентрації. Чим більший об'єм, тим менша концентрація водню небезпечна.
Джерело цієї широко розтиражованої помилки в тому, що вибухонебезпечність досліджувалася в лабораторіях на малих об'ємах. Оскільки реакція водню з киснем — це ланцюгова хімічна реакція, яка відбувається за вільнорадикальним механізмом, втрата вільних радикалів на стінках (або, скажімо, поверхні пилинок) критична для продовження ланцюжка. У випадках, коли можливе створення «граничних» концентрацій у великих обсягах (приміщення, ангари, цехи), слід мати на увазі, що реально вибухонебезпечна концентрація може відрізнятися від 4 % як у більший, так і в менший бік.
Примітки
- Вказано діапазон значень атомної маси в зв'язку з різною поширеністю ізотопів у природі
- Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights(англ.)
- Hydrogen: electronegativities (англ.). Webelements. Процитовано 15 липня 2010.(англ.)
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. с. 240. ISBN 0123526515.(англ.)
- Редкол.:Кнунянц І. Л. (гол. ред.). Химическая энциклопедия: в 5 т. — Москва : Советская энциклопедия. — Т. 1. — С. 400—402. — 100 000 прим.(рос.)
- Magnetic susceptibility of the elements and inorganic compounds. CRC Handbook of Chemistry and Physics (вид. 81st). CRC Press.(англ.)
- Державний стандарт України ДСТУ 2439—94 «Елементи хімічні та речовини прості. Терміни та визначення основних понять. Умовні позначення» / Розробники: М. Ю. Корнілов, О. А. Голуб, В. І. Замковий, А. О. Капшук, Л. Т. Хабалашвілі. — [Чинний від 01.01.1995. Скасований від 01.10.2019.] — К. : Держстандарт України, 1994. — III, 17 с.
- Національний стандарт України ДСТУ 2439:2018 «Хімічні елементи та прості речовини. Терміни та визначення основних понять, назви й символи». — [Чинний від 01.10.2019.] — К. : ДП «УкрНДНЦ», 2019. — С. 2.
- Севергин В. М. Пробирное искусство, или руководство к химическому испытанию металлических руд и других ископаемых тел. СПб.: Издание Имп. АН, 1801. C. 2.
- Книга рекордов Гиннесса для химических веществ(рос.)
- Н. Грінвуд, А. Ерншо. Хімія елементів: у 2-ох томах. — БІНОМ. Лабораторія знань, 2008. — Т. 1. — С. 11. — (Найкращий зарубіжний підручник) — ISBN 978-5-94774-373-9.
- Gribbin, John. Science. A History (1543-2001). — L. : Penguin Books, 2003. — 648 с. — ISBN 978-0-140-29741-6.
- Source for figures: Carbon dioxide, NOAA Earth System Research Laboratory, (updated 2010.06). Methane, IPCC TAR table 6.1 Архівовано 15 червня 2007 у Wayback Machine., (updated to 1998). The NASA total was 17 ppmv over 100 %, and CO2 was increased here by 15 ppmv. To normalize, N2 should be reduced by about 25 ppmv and O2 by about 7 ppmv.(англ.)
- Хорнак Д. П. Основы МРТ(рос.)
- Александр Портнов. Вулканы — месторождения водорода. / Промышленные ведомости, № 10-12 октябрь, декабрь 2010(рос.)
- Гресов А. И., Обжиров А. И., Яцук А. В. К вопросу водородоносности угольных бассейнов Дальнего востока/ Вестник КРАУНЦ. Науки о Земле. 2010, № 1, Выпуск 15. С.19-32.
- http://www.atmos-chem-phys.net/11/3375/2011/acp-11-3375-2011.pdf A new estimation of the recent tropospheric molecular hydrogen budget using atmospheric observations and variational inversion] doi:10.5194/acp-11-3375-2011, 2011 «The main sources of H2 are photochemical production by the transformation of formaldehyde (HCHO) in the atmosphere and incomplete combustion processes. Photolysis of HCHO, a product in the oxidation chain of methane and other volatile organic compounds (VOCs) accounts for 31 to 77 Tg yr−1 and represents half of the total H2 source. Fossil fuel and biomass burning emissions, two incomplete combustion sources, account for similar shares of the global H2 budget (5−25 Tg yr−1). H2 emissions (3−22 Tg yr−1) originating from nitrogen fixation in the continental and marine biosphere complete the sources. H2 oxidation by free hydroxyl radicals (OH) and enzymatic H2 destruction in soils must balance these sources because tropospheric H2 does not show a significant long term trend (Grant et al., 2010)»(англ.)
- Chemistry of the Natural Atmosphere pages 207—201, table 4.14(англ.)
- Global environmental impacts of the hydrogen economy page 61 table 1(англ.)
- David C. Catling and Kevin J. Zahnle, The Planetary Air Leak. As Earth's atmosphere slowly trickles away into space, will our planet come to look like Venus? //SCIENTIFIC AMERICAN, May 2009(англ.)
- http://books.google.ru/books?id=7cBTwb9PETsC&pg=PA296 ISBN 90-277-2418-0, 1987, page 296 chapter 8 table VII «Time (in years) of dissipation of gases from the Earth's atmosphere at different temperatures»(англ.)
- G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties»
- Züttel A., Borgschulte A., Schlapbach L. Hydrogen as a Future Energy Carrier. — Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0 (англ.)
- Hydrogen: electronegativities. Webelements. Процитовано 15 липня 2010.(англ.)
- G. Audi, A.H. Wapstra, and C. Thibault (2003). The AME2003 atomic mass evaluation (II). Tables, graphs, and references.. Nuclear Physics A 729: 337—676. Bibcode:2003NuPhA.729..337A. doi:10.1016/j.nuclphysa.2003.11.003.(англ.)
- Мыльные пузыри с водородом Архівовано 26 липня 2014 у Wayback Machine. — видеоопыт в Единой коллекции цифровых образовательных ресурсов(рос.)
- Под ред. акад. Ю. Д. Третьякова. Неорганическая химия. Том 2. Химия непереходных элементов. — Москва : Академия, 2004. — 368 с. — ISBN 5-7695-1436-1.(рос.)
- Bellona-HydrogenReport(англ.)
- Actual Worldwide Hydrogen Production from …. Arno A Evers. December, 2008. Архів оригіналу за 22 червня 2013. Процитовано 9 травня 2008.
- https://www.hfpeurope.org/infotools/energyinfos__e/hydrogen/main03.html%5Bнедоступне+посилання+з+квітня+2019%5D (англ.)
- High hydrogen yield from a two-step process of dark-and photo-fermentation of sucrose
- Hydrogen production from organic solid matter
- Power from plants using microbial fuel cell
- Crabtree, George W.; Mildred S. Dresselhaus, and Michelle V. Buchanan (December 2004). "The Hydrogen Economy". Physics Today. с. 39. Архів оригіналу за 26 липня 2008. Процитовано 9 травня 2008.
- 2001-High pressure electrolysis — The key technology for efficient H.2[недоступне посилання з квітня 2019]
- Steam heat: researchers gear up for full-scale hydrogen plant (прес-реліз). Science Daily. 18 вересня 2008.(англ.)
- Nuclear Hydrogen R&D Plan (PDF). United States Department of Energy. March 2004. Архів оригіналу за 22 червня 2013. Процитовано 9 травня 2008.(англ.)
- DLR Portal — DLR scientists achieve solar hydrogen production in a 100-kilowatt pilot plant. Dlr.de. 25 листопада 2008. Архів оригіналу за 22 червня 2013. Процитовано 19 вересня 2009.
- [недоступне посилання з квітня 2019](англ.)
- 353 Thermochemical cycles(англ.)
- UNLV Thermochemical cycle automated scoring database (public)[недоступне посилання з квітня 2019](англ.)
- Development of solar-powered thermochemical production of hydrogen from water(англ.)
Література
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.