Окиснення
Оки́снення (також оксиґенація, заст. оки́слення, англ. oxygenation; нім. oxidation) — хімічний процес, під час якого елемент (або сполука) втрачає електрони, при цьому ступінь окиснення її елементів збільшується. Назва пов'язана з киснем, оскільки взаємодія субстанцій з киснем, озоном, пероксидами та іншими окисниками з утворенням кисневих сполук належить до найпоширеніших (і перших вивчених) процесів окиснення. За іншим тлумаченням, окиснення є лише різновидом реакції окислення за участю кисню — в цьому розумінні, вживання терміну «окиснення» у випадках, коли хімічна реакція відбувається без участі кисню, є помилкою.
Опис
- Відновлення: Речовина В як окисник приймає електрон.
- Окисно-відновна реакція: Речовина А віддає електрон речовині В.
При окисненні речовини в результаті віддачі електронів збільшується її ступінь окиснення. Атоми окисника називаються акцепторами електронів на противагу атомам відновника, що втрачають електрони і тому називаються донорами. В деяких випадках, молекула вихідної сполуки може стати нестабільною та розпастися на стабільніші та дрібніші складові. При цьому деякі з атомів мають вищий ступінь окиснення, ніж ті самі атоми у вихідній молекулі.
Окисник, коли приймає електрони, набуває відновних властивостей та перетворюється в спряжений відновник:
окисник + e− ↔ спряжений відновник.
Окиснення, зокрема — це реакції сполучення кисню з простими і складними речовинами. Ці реакції відбуваються з різними швидкостями. Якщо реакції окиснення проходять швидко і супроводжуються виділенням значної кількості тепла і світла (полум'я), їх називають реакціями горіння, або просто горінням. Повільно відбуваються тління, гниття і дихання.
Внаслідок О., наприклад, вугілля відбувається зниження відносного вмісту водню та вуглецю при збільшенні вмісту кисню. Одночасно знижується питома теплота згоряння, підвищується вологість, зольність, вихід летких речовин, знижується, а іноді й повністю втрачається коксівна здатність. Окисник – реактант, за допомогою якого вводиться кисень в субстрат (тобто останній окиснюється).
Горіння
В атмосфері повітря (і в чистому кисні) можуть горіти різні речовини: більшість металів, сірка, сірководень H2S, монооксид вуглецю CO, пірит FeS2 і величезна кількість органічних речовин. Однак найбільше практичне значення як горючі речовини (паливо) мають: природний газ, нафта, вугілля, торф тощо. Ці речовини складаються головним чином з вуглецю і водню, а також містять у незначних кількостях сірку, азот та інші елементи.
Кінцевими продуктами горіння (окиснення) простих речовин є їх оксиди, а повного згоряння звичайного палива — CO2, H2O, SO2 і N2. Для повного згоряння завжди потрібний певний надлишок кисню (повітря). При неповному спалюванні (при нестачі кисню) можуть утворюватися CO, S тощо. Наприклад:
- 2H2S + 3O2 = 2SO2 + 2H2O (повне згоряння);
- 2H2S + O2 = 2S + 2H2O (неповне згоряння).
У чистому кисні горіння відбувається набагато енергійніше, ніж в атмосфері повітря. Так, якщо тліючу лучинку внести в чистий кисень, вона спалахує і горить яскравим полум'ям. Запалена сірка на повітрі горить ледве помітним голубуватим полум'ям, а в атмосфері кисню інтенсивно згоряє яскравим полум'ям:
- S + O2 = SO2.
Розжарена залізна дротина на повітрі не горить, а в кисні згоряє з тріском, розкидаючи іскри:
- 3Fe + 2O2 = Fe3O4.
При горінні однакової кількості речовини в чистому кисні і в повітрі виділяється однакова кількість тепла. Але горіння в кисні відбувається скоріше і за одиницю часу тепла виділяється більше. Крім того, при горінні, в кисні тепло не витрачається на нагрівання азоту. Тому температура горіння в чистому кисні значно вища, ніж температура горіння в повітрі.
Процеси горіння (з виділенням тепла і світла) можуть відбуватися не тільки в атмосфері кисню (повітря), а і в атмосфері деяких інших газів. Наприклад, розжарена залізна дротина горить в атмосфері хлору, а мідна фольга — в парах сірки:
- 2Fe + 3Cl2 = 2FeCl3
- 2Cu + S = Cu2S
При цьому хлор і сірка є окисниками. Проте для процесів горіння палива практичне значення як окисник має тільки кисень.
Повільне окиснення
Не всі процеси окиснення з участю кисню є процесами горіння. Багато з них відбувається повільно вже при звичайній температурі. До таких процесів належать, зокрема, явища тління, гниття і дихання.
Процеси тління і гниття мають надзвичайно велике гігієнічно-санітарне значення, оскільки при цьому всі залишки рослинних і тваринних організмів перетворюються в неорганічні сполуки, головним чином у CO2, H2O і N2.
Під час повільного окиснення органічних речовин виділяється така сама кількість тепла, як і при їх горінні. Однак внаслідок повільного процесу невеликі кількості тепла, що виділяються, встигають розсіятися в оточуючому середовищі, і тому гниюча речовина не нагрівається. Але коли відвід тепла затруднений (наприклад, у великих купах), тоді вона нагрівається. Цим, зокрема, пояснюється розігрівання вологого сіна в копицях, сирого зерна тощо. На цьому основується також застосування гною для нагрівання ґрунту в парниках.
Повільне окиснення горючих речовин при поганому відводі тепла може призвести навіть до їх самозаймання. Так, самозайматися може вугілля, складене у великі купи, забруднені мінеральним маслом ганчірки, що довго лежать купою тощо.
Дихання
Повільне окиснення лежить в основі і такого важливого життєвого процесу, як дихання. При диханні кисень повітря в легенях сполучається з гемоглобіном крові, утворюючи оксигемоглобін, який надає артеріальній крові яскраво-червоного забарвлення і розноситься по всьому організму. Там оксигемоглобін розкладається і кисень, що виділяється, окиснює поживні речовини організму, утворюючи CO2, H2O та інші продукти. Діоксид вуглецю розчиняється в крові і виноситься нею по венах в легені, де видихається. Позбавлена оксигемоглобіну венозна кров має темно-червоний колір. При повільному окисненні поживних речовин організму виділяється тепло, яке й забезпечує нормальну життєдіяльність і температуру організму.
Приклади окиснення в органічній хімії
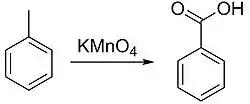
Прикладом застосування окиснення в органічній хімії може слугувати лабораторний метод отримання бензойної кислоти з толуену[1]:
Див. також
- Окислення
- Окиснювально-відновна реакція
- Окисник
- Відновлення
- Редокс
- Окси-плівка
- Автоокиснення
- Рівень окиснення
- співокиснення
- УФ-окиснення
- Арен-ангідридна оксидація
Примітки
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — Вид. 2-ге, перероб. і доп. — Львів : Центр Європи, 2001. — ISBN 966-7022-19-6. (С.?)
Джерела
- Глінка М. Л. Загальна хімія : підручник. — 2-ге вид., перероб. і доп. — Київ : Вища школа, 1982. — 608 с. (С.?)
- Ф. А. Деркач "Хімія" Л. 1968 (С.?)
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2. (С.?)
- Тлумачний термінологічний словник з органічної та фізико-органічної хімії // укладачі Й.Опейда, О.Швайка. - К.: Наукова думка. - 1997. 532 с. (С.?)
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0. (С.?)
Посилання
- Окиснення металів // Термінологічний словник-довідник з будівництва та архітектури / Р. А. Шмиг, В. М. Боярчук, І. М. Добрянський, В. М. Барабаш ; за заг. ред. Р. А. Шмига. — Львів, 2010. — С. 137. — ISBN 978-966-7407-83-4.
- ОКИСНЕННЯ БІОЛОГІЧНЕ // Фармацевтична енциклопедія
- ОКИСНЕННЯ МІКРОСОМАЛЬНЕ // Фармацевтична енциклопедія
- ОКСИДАЦІЯ // Фармацевтична енциклопедія
- ПЕРОКСИДНЕ ОКИСНЕННЯ // Фармацевтична енциклопедія
