Гексаметилфосфотриамід
Гексаметилфосфотриамід, часто скорочено ГМФТА, а також гексаметапол, Амід фосфорної кислоти) з формулою [(CH3)2N]3PO. Ця безбарвна рідина є висококплячим сильно полярним апротонним органічним розчинником що використовується в органічному синтезі.
| Гексаметилфосфотриамід | |
|---|---|
 | |
 | |
| Інші назви | Гексаметапол HMPA ГМФТА |
| Ідентифікатори | |
| Номер CAS | 680-31-9 |
| PubChem | 12679 |
| Номер EINECS | 211-653-8 |
| KEGG | C19250 |
| ChEBI | 24565 |
| RTECS | TD0875000 |
| SMILES |
O=P(N(C)C)(N(C)C)N(C)C |
| InChI |
1/C6H18N3OP/c1-7(2)11(10,8(3)4)9(5)6/h1-6H3 |
| Номер Бельштейна | 1099903 |
| Номер Гмеліна | 3259 |
| Властивості | |
| Молекулярна формула | C6H18N3OP |
| Молярна маса | 179,2 г/моль |
| Зовнішній вигляд | Прозора безбарвна рідина |
| Запах | майже не пахне, через наявність домішок, може відчуватися запах амінів |
| Густина | 1.03 g/cm3 |
| Тпл | 7.20 |
| Розчинність (вода) | змішується з водою у всіх проплрціях |
| Тиск насиченої пари | 0.03 mmHg (20 °C) |
| Небезпеки | |
| Класифікація ЄС | |
| Головні небезпеки | carcinogen |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Структура й властивості
Гексаметилфосфотриамід можна розглядати як тримід фосфатної кислоти. Він може бути отриманий реакцієо оксихлориду фосфору з диметиламіном.[1]
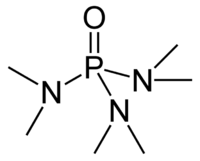
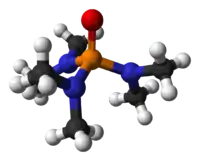
Молекула ГМФТА має форму тетраєдра з атомом фосфору і трьома диметиламіно групапи та одним киснем у вершинах. Оскільки три диметеламіногрупи є сильноднорними замісниками зв'язок P=O є сильно поляризованим з помітним негативним зарядом на оксигені. Через це ГМФТА проявляє деякі власитивості фосфіноксидів, скажімо здатен координуватися до іонів металів. Також оксиген ГМФТА утворює міцні водневі зв'язки з протонодонорними сполуками, що зокрема забезпечує його надзвичайно хорошу розчинність у воді та гігроскопічність.
Застосування
ГМФТА використовується як розчинник для полімерів, газів та органометалічних сполук. Висока полярність (вища за полярність ДМСО та ДМФА, а також висока температура кипіння (233 °C) дозволяють розчинити в ГМФТА сполуки нерозчинні в інших розчинниках. Він селективно сольватує катіони залишаючи малосольватованими й активними аніони чим пришвидшує відносно повільні реакції SN2 заміщення. При розчиненні в ГМФТА тетрамери бутиллітію розпадаються на мономери що сильно покращує селективність реакцій літіювання.[2]
ГМФТА здатен розчиняти невелику кількість металічного натрію утворюючи іони Na+ та блакитні аніонрадикали («сольвати електрону»)[3][4] Ці розчини легко втрачають колір при контакті з киснем повітря, через що голубі розчини натрію в ГМФТА інколи застосовуються в хіміками для детектування домішки кисню в газах.
Токсичність
ГМФТА може викликати рак і є набагато більш небезпечним за аналогічні полярні апротонні розчинники (ДМСО, тетраалкілсечовини).
Примітки
- Pavankumar, B.B.; Goud, E.V.; Selvakumar, R.; Kumar, S.K.A.; Sivaramakrishna, A.; Vijayakrishna, K.; Rao, C.V.S.; Sabharwal, K.N.; Jha, P.C.: Function of substituents in coordination behaviour, thermolysis and ligand crossover reactions of phosphine oxides in RSC Advances 5 (2015) 4727–4736, DOI:10.1039/c4ra13645d.
- Dykstra, R. R. (2001). «Encyclopedia of Reagents for Organic Synthesis». Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons. doi:10.1002/047084289X.rh020. ISBN 0471936235.
- Luehrs, Dean C; Kohut, John P (1974). Hexamethylphosphoramide solvates of alkali metal salts. Journal of Inorganic and Nuclear Chemistry 36 (7): 1459–60. doi:10.1016/0022-1902(74)80605-6.
- Gremmo, Norberto; Randles, John E. B (1974). Solvated electrons in hexamethylphosphoramide. Part 1.—Conductivity of solutions of alkali metals. Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases 70: 1480–7. doi:10.1039/F19747001480.
Посилання
- Hexamethyl phosphoramide. NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention, Department of Health and Human Services. 2011.