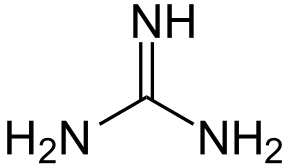
Гуанідин
Гуанідин — безбарвна кристалічна речовина, розпливається на повітрі внаслідок поглинання вологи. Сильна однокислотна основа pKa=12.5 . З HCl, HNO3 утворює стійкі солі.
| Гуанідин | |
 | |
| Маса | 9,8E−26 кг[1] |
|---|---|
| Спряжена кислота | guanidiniumd |
| Хімічний символ | Gu |
| Хімічна формула | CH₅N₃[1] |
| Канонічна формула SMILES | C(=N)(N)N[1] |
| Стандартна ентальпія утворення | −56,01 кілоджоуль на моль |
| Температура плавлення | 50 °C |
| Наявна у таксона | Canavalia ensiformisd, Citrus ×natsudaidaid[3], мандарин[3], Мандарин Уншіу[3], Diospyros virginianad[3], мушмула японська звичайна[3], яблуня домашня[3], Яблуня лісова[3], Яблуня домашня[3], Люцерна посівна, Персик[3], Конюшина лучна, Конюшина повзуча, Hippospongia communis[4], Eulophia bicallosad[5], Liparis formosanad[5] і Spongia equinad[4] |
| Код MCN | 2925.29.21 |
| | |
Історія
Знаходиться в сечі як продукт нормального метаболізм білки. Речовина була вперше синтезована окислювальною деградацією природних ароматичних продуктів, гуаніну, виділеного з перуанського гуано[6]. Незважаючи на простоту будови молекули, кристалічна структура була вперше описана на 148 років пізніше відкриття.[7].

Властивості
Легко алкілюється. Володіє фунгіцидною і бактерицидною активністю.
Отримання
- У промисловості гуанідини отримують сплавленням солей амонію з сечовиною або ціаніду,
- NH4NO3 + 2(NH2)2CO → (NH2)2C=NH*HNO3 + CO2 + 2NH3
- а також гидрогенолізом циангуанідина на нікелі Ренея:
- NH2-C(=NH)-NH-CN → [H2, Ni] NH2-C(NH)-NH2
- Витягують за допомогою іонообмінних смол з відходів виробництва сечовини.
- Карбонат витягують з відходів виробництва меламіну
- Інші солі отримують по реакції з основою гуанідину
- Спиртові розчини при реакції хлориду гуанідину з відповідними алкоголятами
Протонування і основність
Гуанідин завдяки резонансній делокалізації заряду в симетричному гуанідінієвому катіоні, що утворюється при протонуванні гуанідину, є сильною основою, порівнянним за силою (рКа = 13,5) з гідроксидом натрію.
Висока основність характерна і для заміщених гуанідинів: так, гуанідіновая група амінокислоти аргініну (pKa 12.48) протонована у фізіологічних умовах (при pH < 10).
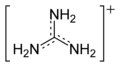
резонансна структура 
канонічна форма
Гуанідинхлорид використовують для денатурації білків. Причому концентрація і вільна енергія розкриття знаходяться в лінійній залежності. З цією ж метою використовується і тіоціанат гуанідинія.
Похідні гуанідину
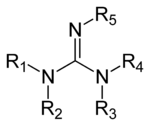
Гуанідин — група органічних сполук із загальною структурою (R1R2N)(R3R4N)C=N-R5. Центральний зв'язок всередині цієї структури — імінова; інша розпізнавана субструктура — аміналь. Приклади гуанідинів: аргінін, триазобициклодецен і сакситоксин. Інші похідні можуть включати гуанідин гідроксид. Гуанідинові солі добре відомі завдяки їх денатуруючій дії на білки. Гуанідин хлорид найбільш відомий денатурант. У його 6 М розчині практично всі білки з впорядкованою структурою втрачають свою впорядкованість.
Бігуаніди - гіпоглікемічні лікарські засоби, що використовуються при цукровому діабеті. Молекули бігуанідів складаються з поліметиленового ланцюжка і гуанідінової групи на обох її кінцях.
Застосування
- Солі гуанідину, застосовують в промисловості:
- — динітрат — як вибухова речовина,
- — нітрат — в якості монопалива
- — фосфат — в текстильній промисловості для додання вогнетривких властивостей тканинам,
- — карбонат — в синтезі поверхнево-активних речовин і косметиці для випрямлення волосся
- Продукт конденсації гуанідіна з формальдегідом використовується як іонообмінна смола.
- Він також застосовується у виробництві пластмас.
- В якості перспективного альтернативного палива[8]
- Нітрогуанідин, нітрат гуанідінія, перхлорат гуанідінія використовують в якості ракетного палива.
- Хромат-інгібітор корозії
Безпека
Токсичний, викликає при попаданні на шкіру і в дихальні шляхи лужний опік.
Примітки
- guanidine
- KATO T., YAMAGATA M., TSUKAHARA S. Guanidine Compounds in Fruit Trees and Their Seasonal Variations in Citrus (Citrus unshiu Marc.) // Japanese Society for Horticultural Science. Journal — Japanese Society for Horticultural Science, 2008. — Vol. 55, Iss. 2. — P. 169–173. — ISSN 1882-3351; 0013-7626; 1880-358X — doi:10.2503/JJSHS.55.169
- D. Ackermann, Menßen H. G. N-haltige Inhaltsstoffe des PferdeschwammesHippospongia equina // Hoppe-Seyler's Zeitschrift für physiologische Chemie — B: Verlag Walter de Gruyter, 2011. — Vol. 322, вип. Jahresband. — S. 198–207. — ISSN 0018-4888 — doi:10.1515/BCHM2.1960.322.1.198
- K Nishikawa, Y Hirata Chemotaxonomical alkaloid studies. 3. Further studies of Liparis alkaloids // Tetrahedron Lett. — Elsevier BV, 1968. — Vol. 9, Iss. 60. — P. 6289–6291. — ISSN 0040-4039; 1873-3581 — doi:10.1016/S0040-4039(00)75456-6
- A. Strecker, Liebigs Ann. Chem. 1861, 118, 151.
- T. Yamada, X. Liu, U. Englert, H. Yamane, R. Dronskowski, Chem. Eur. J. 2009, 15, 5651.
- European Patent Office application EP20050746871[недоступне посилання з Июнь 2018]