Гідроксид натрію
Гідрокси́д на́трію, натрій гідроксид, каустична сода або просто каустик — неорганічна сполука, гідроксид складу NaOH. Являє собою білі, непрозорі та дуже гігроскопічні кристали. Речовина добре розчинна у воді — при з'єднанні з водою виділяється велика кількість тепла. Проявляє сильні лужні властивості. Значення pH 1%-го водного розчину становить 13. Гідроксид натрію є їдкою сполукою, при потраплянні на шкіру викликає омилення жирів та хімічні опіки, спричиняє корозію окремих металів. Речовина застосовується у виробництві численних продуктів, зокрема, поверхнево-активних речовин, паперу, косметики, лікарських засобів.
| Гідроксид натрію | |
|---|---|
 | |
 | |
| Назва за IUPAC | Натрій гідроксид |
| Інші назви | їдкий натр, їдкий натрій, гідроокис натрію, натрієвий луг, каустик, каустична сода |
| Ідентифікатори | |
| Номер CAS | 1310-73-2 |
| Номер EINECS | 215-185-5 |
| DrugBank | 11151 |
| KEGG | D01169 і C12569 |
| ChEBI | 32145 |
| RTECS | WB4900000 |
| SMILES |
[OH-].[Na+][1] |
| InChI |
InChI=1S/Na.H2O/h;1H2/q+1;/p-1 |
| Номер Гмеліна | 68430 |
| Властивості | |
| Молекулярна формула | NaOH |
| Молярна маса | 39,997 г/моль |
| Зовнішній вигляд | білі кристали |
| Запах | без запаху |
| Густина | 2,13 г/см³[2] 1,77 г/см³ (350 °C, рідина) |
| Тпл | 323 °C[2] |
| Ткип | 1388 °C[2] |
| Розчинність (вода) | 100 г/100 г H2O |
| Термохімія | |
| Теплоємність, c |
3,24 Дж/(моль·K) |
| Пов'язані речовини | |
| Інші аніони | оксид натрію, хлорид натрію |
| Інші катіони | гідроксид калію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Гідроксид натрію NaOH — біла тверда речовина. Залишений на повітрі їдкий натрій незабаром розпливається, оскільки притягує вологу з повітря. Речовина добре розчиняється у воді, при цьому виділяється велика кількість теплоти.
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| Розчинність, %[3] | 30 | 39 | 46 | 50 | 53 | 58 | 63 | 71 | 74 | 76 | 76 | 79 |
Розчинність в метанолі складає 23,6 г/л (при 28 °C), в етанолі — 14,7 г/л (28 °C).
Розчин їдкого натру милкий на дотик.
Термодинаміка розчинів
Ентальпія розчинення для нескінченно розведеного водного розчину складає −44,45 кДж/моль.
З водних розчинів кристалізуються гідрати:
- при 12,3—61,8 °C — моногідрат NaOH·H2O (сингонія ромбічна, температура плавлення 65,1 °C; густина 1,829 г/см³;ΔH0утв −425,6 кДж/моль);
- в інтервалі −28…−24 °C — гептагідрат NaOH·7H2O;
- від −24 до −17,7 °C — пентагідрат NaOH·5H2O;
- від −17,7 до −5,4 °C — тетрагідрат NaOH·4H2O (α-модифікація);
- від −8,8 до 15,6 °C — NaOH·3,5Н2О (температура плавлення 15,5 °C).
- від 0 °C до 12,3 °C — дигідрат NaOH·2H2O;
Отримання
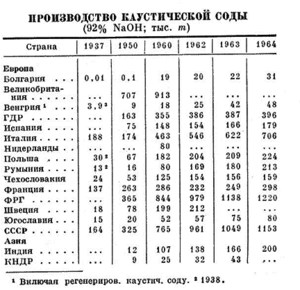
Історично першим методом отримання гідроксиду натрію була взаємодія соди Na2CO3 та гашеного вапна Ca(OH)2 у водному розчині:
Проведенню реакції сприяє перемішування та висока температура, тому її здійснювали у сталевих реакторах із мішалками. Після отримання продуктів, від продуктів відділяли малорозчинний карбонат кальцію та випарювали залишковий розчин гідроксиду натрію при 180 °C у чавунних ємностях без доступу повітря. Таким чином можна було отримати розчин концентрацією до 95%.
У 1892 році незалежно один від одного американський вчений Гамільтон Кастнер та австрієць Карл Кельнер відкрили спосіб отримання гідроксиду електролізом хлориду натрію, який широко розповсюджений у промисловості. Перебіг реакцій можна описати сумарним рівнянням:
Цей метод і донині є основним промисловим способом добування NaOH, однак деякі умови проведення синтезу зазнавали модифікацій. Зокрема, для запобігання протіканню реакцій між продуктами та вихідними речовинами різні етапи взаємодії проводять в окремих реакторах або ж розмежовуються. За цим критерієм розрізняють три основні методи: ртутний, діафрагменний та мембранний.
Ртутний процес
В оригінальному методі синтезу NaOH як катод використовується ртутний електрод. Потрапляючи на катод, іони натрію утворюють там рідкі амальгами змінного складу NaHgn:
Амальгами виділяються з реакційної системи і переводяться в іншу, де відбувається розкладання амальгами водою з утворенням гідроксиду натрію:
За цим методом утворюється розчин NaOH концентрацією 50—73% та практично чистий від забруднюючих домішок (хлору, хлориду натрію). Утворена в результаті розкладання ртуть повертається в електрод.
На аноді (графітовому чи іншому) відбувається окиснення хлорід-іонів з утворенням вільного хлору:
Окрім цього, мають місце також побічні реакції: окиснення гідроксид-іону та електрохімічне утворення хлорат-іону. Гідролізом отриманого хлору можуть утворюватися і незначні кількості гіпохлорит-іонів.
Діафрагменний процес
У діафрагменному методі простір між катодом та анодом розмежований перегородкою, яка не пропускає розчини і гази, однак не перешкоджає проходженню електричного струму та міграції іонів. Зазвичай, як такі перегородки використовується азбестова тканина, пористі цементи, порцеляна тощо.
В анодний простір подається розчин NaCl: на аноді (графітовому або титановому з оксидними покритями або покриттям платиновими металами ( магнетитові мають завеликий опір та перенапругу виділення хлору , тому в промисловості широко не використовуються )) відновлюються хлорид-іони, а катіони Na+ (та, частково, аніони Cl-) мігрують крізь діафрагму до катодного простору. Там катіони не сполучаються із гідроксид-іонами, утвореними відновленням води на залізному або мідному катоді:
З катодного простору в результаті виділяється суміш гідроксиду та хлориду натрію із вмістом NaOH 10—15% (та близько 18% NaCl). Шляхом випаровування вдається збільшити концентрацію гідроксиду до 50%, але вміст хлориду все одно залишається суттєвим. Для виділення хлориду з суміші, її обробляють рідким аміаком із утворенням легковідділюваного хлориду амонію (однак, цей спосіб є малопоширеним через високу вартість його проведення). Також застосовується метод, який полягає в охолодженні суміші та виділенні кристалів гідрату NaOH·3,5H2O, які в подальшому додатково дегідратують.
Хоча магнетитові не використовуються в промисловості їх, в модифікованому вигляді можна виготовити та використовувати в домашніх умовах при наявності листового титану та концентрованої сульфатної кислоти (для протравлення оксидного шару): частина титанового електроду яка в майбутньому має бути занурена в хлоридний розчин протравлюється в концентрованій сульфатній кислоті кілька хвилин і без змивання кислоти занурюється в розчин сульфату заліза або солі Мора як катод (анод логічно робити залізним - тоді склад електроліту залишатиметься малозмінним). Після гальванічного покриття титану залізом електрод відпалюється на повітрі для закріплення зв'язку титану із залізом та переведення заліза в магнетит. З непротравленого аноду магнетитовий шар в процесі роботи швидко обсиплеться. Вугільні аноди досить швидко розсипаються.
Мембранний процес
Цей спосіб був розроблений у 1970-х роках компанією «DuPont» і вважається найбільш досконалим з існуючих. У мембранному процесі в реакторі встановлюється катіонообмінна мембрана, яка є проникною для іонів Na+, що рухаються у катодний простір, і пригнічує міграцію гідроксид-іонів, які мігрують у зворотньому напрямку — таким чином у катодному просторі збільшується концентрація складових NaOH. Економічно вигідною для синтезу вважається концентрація 30—35%, а новітні мембрани дозволяють збільшити це значення до 50%.
За цим методом хлорид натрію теоретично не утворюється, але проникнення хлорид-іонів крізь мембрану усе ж може мати місце.
Катіонпровідні мембрани використовуються в літій-полімерних акумуляторах . Це співполімери з тетрафлуоретиленом , технологічно виготовлені з кількох несиметрично розміщених шарів шарів . Зовнішній вигляд - тефлонова плівка .
Отримання твердого NaOH
Твердий NaOH (каустична сода) отримують випарюванням його розчину до вмісту води менше за 0,5—1,5%. Спочатку 50%-ий розчин випарюють у вакуумі до концентрації 60%, а концентрацію 99% досягають із застосуванням теплоносіїв (суміш NaNO2, NaNO3, KNO3) за температури понад 400 °C: розчин подається насосом у розігріту камеру для випаровування, де відокремлюється решта води.
Випарювання розчину NaOH проводять в залізних , нікелевих , кобальтових або срібних ємностях. Скло, порцеляна, платина в присутності кисню розплавом руйнуються .
Марки
Гідроксид натрію випускається у двох видах: твердому та рідкому. Тверда гранульована каустична сода являє собою білу тверду масу з розміром лусочок 0,5-2 см. Рідкий розчин каустичної соди — безбарвний. Комерційно важливими є розчини гідроксиду натрію із концентрацією у 50%.
Технічний їдкий натр випускають таких марок:
- ТР — твердий ртутний;
- ТД — твердий діафрагмовий (плавлений);
- РР — розчин ртутний;
- РХ — розчин хімічний;
- РД — розчин діафрагмовий.
Хімічні властивості
Гідроксид натрію активно поглинає вологу з повітря, утворюючи гідрати різного складу, які розкладаються при нагріванні:
У розчинах сполука добре дисоціює:
Проявляючи сильні лужні властивості, гідроксид натрію легко взаємодіє з кислотами, кислотними та амфотерними оксидами і гідроксидами:
NaOH легко взаємодіє із галогенами, а за високих температур — також і з металами:
При взаємодії з солями, що є похідними слабких основ, утворюються відповідні гідроксиди:
Реагуючи із монооксидом вуглецю, синтезується форміат натрію:
Вимоги безпеки
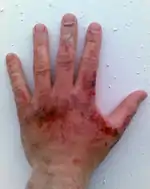
Сода каустична пожежо- та вибухобезпечна. Їдка, корозійно активна речовина. За ступенем впливу на організм відноситься до речовин 2-го класу небезпеки. Як тверда речовина, так і концентровані її розчини викликають дуже сильні опіки. Попадання лугу в очі може призвести до їх важких захворювань і навіть до втрати зору. При попаданні на шкіру, слизові оболонки, очі утворюються сильні хімічні опіки. При потраплянні на шкіру — промити слабким розчином оцтової кислоти.
При роботі використовують захисні засоби: захисні окуляри, гумові рукавички, прорезинений хімічностійкий одяг.
Застосування
Гідроксид натрію застосовується в багатьох галузях промисловості та у побуті:
- Каустик застосовується в целюлозно-паперовій промисловості для делігніфікації (сульфатний процес) целюлози, у виробництві паперу, картону, штучних волокон, деревно-волоконних плит.
- Для омилення жирів при виробництві мила, шампуню та інших миючих засобів. Останнім часом продукти на основі гідроксиду натрію (з додаванням гідроксиду калію, нагріті до 50—60 градусів Цельсія, застосовуються в сфері промислової мийки для очищення виробів з нержавіючої сталі від жиру та інших масляних речовин, а також залишків механічної обробки.
- В хімічних галузях промисловості — для нейтралізації кислот і кислотних оксидів, як реагент або каталізатор в хімічних реакціях, в хімічному аналізі для титрування, для травлення алюмінію та у виробництві чистих металів, в нафтопереробці — для виробництва масел.
- Для виготовлення біодизельного палива — яке отримують з рослинних олій і використовують для заміни звичайного дизельного палива. Для отримання біодизелю до дев'яти масових одиниць рослинної олії додають одну масову одиницю спирту (тобто дотримується пропорція 9:1), а також лужний каталізатор (NaOH). Отриманий ефір (головним чином лінолевої кислоти) відрізняється чудовою займистістю, що забезпечується високим цетановим числом. Якщо для мінерального дизпалива характерний показник в 50—52%, то метиловий ефір відповідно 56—58% цетана. Сировиною для виробництва біодизеля можуть бути різні рослинні олії: ріпакова, соєва та інші, крім тих, у складі яких високий вміст пальмітинової кислоти (пальмова олія). При її виробництві в процесі етерифікації також утворюється гліцерин, що використовується в харчовій, косметичній та паперовій промисловості або переробляється в епіхлоргідрин за методом Сольве.
- Як агент для розчинення засмічень каналізаційних труб, у вигляді сухих гранул або у складі гелів. Гідроксид натрію дезагрегує засмічення і сприяє легкому просуванню його далі по трубі.
- В цивільній обороні для дегазації та нейтралізації отруйних речовин, у тому числі зарину, в ребрізерах (ізолюючих дихальних апаратах (ІДА), для очищення повітря, що видихається, від вуглекислого газу.
- Гідроксид натрію також використовується для мийки прес-форм автопокришок.
- В приготуванні їжі: для миття та очищення фруктів та овочів від шкірки, у виробництві шоколаду і какао, напоїв, морозива, фарбуванні карамелі, для розм'якшення маслин і надання їм чорного забарвлення, при виробництві хлібобулочних виробів. Зареєстровано як харчову добавку E524.
- У косметології для видалення ороговілих ділянок шкіри: бородавок, папілом.
Примітки
- SODIUM HYDROXIDE
- За тиску 101,3 кПа
- Значення розчинності у відсотках розраховується як відношення маси розчиненої речовини до маси усього розчину
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Myers Richard L. The 100 Most Important Chemical Compounds. — Westport, CT : Greenwood Press, 2007. — 326 p. — ISBN 978-0-313-33758-1. (англ.)
- Kurt C., Bittner J. Sodium Hydroxide // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — 12 p. — DOI: (англ.)
- Schmittinger P., Florkiewicz T., Curlin L. C. Chlorine // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 8-57. — DOI: (англ.)
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
