Гідроксиламін
Гідроксиламін — реактивна хімічна речовина з хімічною формулою NH2OH. За кімнатної температури NH2OH зазвичай біла, нестабільна, кристалічна та гігроскопічна сполука.[4] Гідроксиламін та його солі використовують як відновники в багатьох органічних та неорганічних реакціях.[2] Сполука є небезпечною, оскільки вона може вибухнути при нагріванні. Гідроксиламін також подразнює дихальні шляхи, шкіру, очі та інші слизові оболонки. Він може абсорбуватися через шкіру та є шкідливим при попаданні всередину.[5] Гідроксиламін — мутаген.[6]
| Гідроксиламін | |
|---|---|
 Hydroxylamine |
 Hydroxylamine |
 | |
| Назва за IUPAC | Гідроксиламін |
| Ідентифікатори | |
| Номер CAS | 7803-49-8 |
| PubChem | 787 |
| Номер EINECS | 232-259-2 |
| KEGG | C00192 |
| ChEBI | 15429 |
| RTECS | NC2975000 |
| SMILES |
NO[1] |
| InChI |
InChI=1S/H3NO/c1-2/h2H,1H2 |
| Номер Гмеліна | 478 |
| Властивості | |
| Молекулярна формула | NH2OH |
| Молярна маса | 33?030 г/моль |
| Зовнішній вигляд | білі голки чи хлоп'я |
| Густина | 1,21 г/см3 (20 °C)[2] |
| Тпл | 33 °C |
| Ткип | 58 °C (розкладання) |
| Розчинність (вода) | розчинний у холодній воді, розкладається в гарячій воді |
| Розчинність | гарно розчинний у рідкому аміаку, спирті |
| Кислотність (pKa) | 5,94 |
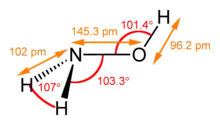
| Структура | |
| Дипольний момент | 0,67553 D |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
−39,9 кДж/моль |
| Небезпеки | |
| ЛД50 | 408 мг/кг (орально, миши); 59–70 мг/кг (внутрішньобрюшно для мишей та крис); 29 мг/кг (підшкірно для крис)[3] |
| MSDS | ICSC 0661 |
| Індекс ЄС | 612-122-00-7 (solution, >55%) 612-122-01-4 (solution, <55%) |
| Класифікація ЄС | канцероген (3-тій клас |
| NFPA 704 |
 0
2
3
|
| Температура спалаху | 129 °C (вибухає) |
| Температура самозаймання | 265 °C |
| Пов'язані речовини | |
| Пов'язані речовини | Аміак Гідразин |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Використання
В промисловості гідроксиламін використовується при виробництві полімеру капрону. Він реагує з циклогексаноном з утворенням оксиму, що потім переводять шляхом перегрупування Бекмана в капролактам, який вже полімеризують в капрон.
Примітки
- PubChem
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. с. 362. ISBN 1903996651.
- Greenwood and Earnshaw. Chemistry of the Elements. 2nd Edition. Reed Educational and Professional Publishing Ltd. pp. 431-432. 1997.
- Гідроксиламін на сайті Sigma-Aldrich
- J. H. Phillips, and D. M. Brown (1967). The Mutagenic Action of Hydroxylamine. Progress in Nucleic Acid Research and Molecular Biology (Elsevier Inc.) 7: 349—368. doi:10.1016/S0079-6603(08)60956-3.