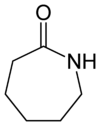
Капролактам
Капролакта́м (лактам капронової кислоти) — органічна сполука ряду лактамів складу C6H11NO. За звичайних умов є білою, гігроскопічною кристалічною речовиною з температурою плавлення 69,3 °C.
| Капролактам | |
|---|---|
 |
 |
| Назва за IUPAC | азепан-2-он |
| Інші назви | лактам ε-амінокапронової кислоти, 6-гексанлактам, гексагідро-2H-азепін-2-он, 2-оксогексаметиленімін |
| Ідентифікатори | |
| Номер CAS | 105-60-2 |
| Номер EINECS | 203-313-2 |
| KEGG | C06593 |
| Назва MeSH | D02.065.589.200, D03.383.066.150 і D03.383.411.200 |
| ChEBI | 28579 |
| RTECS | CM3675000 |
| SMILES |
C1CCC(=O)NCC1[1] |
| InChI |
InChI=1S/C6H11NO/c8-6-4-2-1-3-5-7-6/h1-5H2,(H,7,8) |
| Номер Бельштейна | 106934 |
| Номер Гмеліна | 101802 |
| Властивості | |
| Молекулярна формула | C6H11NO |
| Молярна маса | 113,157 г/моль |
| Густина | 1,0135 г/см³ [2] |
| Тпл | 69,3 °C[3] |
| Ткип | 270 °C[3] |
| Розчинність (вода) | 84,0% |
| Показник заломлення (nD) | 1,4768[4] |
| В'язкість | 8,85 мПа·с[2] |
| Дипольний момент | 3,9 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-329,4 кДж/моль |
| Теплоємність, c |
156,8 Дж/(моль·K) |
| Небезпеки | |
| Температура спалаху | 125 °C |
| Температура самозаймання | 375 °C |
| Вибухові границі | 1,4% об. (135 °C) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
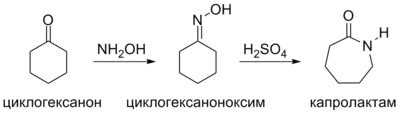
Вперше капролактам синтезували С. Габріель і Т. Маас у 1899 році циклізацією капронової кислоти. Іншим способом отримав сполуку Отто Валлах — синтезувавши її з циклогексанону за допомогою перегрупування Бекмана.
Комерційний інтерес до капролактаму з'явився у 1938 році, коли Пауль Шлак з IG Farben вперше здійснив його поліконденсацію. Відтоді він став важливою сировиною для отримання полімерів. Так, у 1989 році світовий об'єм виробництва капролактаму для потреб синтезу полімерів склав 2 млн тонн, а в 1994 році — 2,2 млн тонн.
Фізичні властивості
Капролактам є білою, кристалічною речовиною із характерним запахом. Він добре розчинний у воді, бензені, етанолі, хлороформі.
| Розчинник | Температура | |||
|---|---|---|---|---|
| 20 °C | 30 °C | 40 °C | 50 °C | |
| Вода | 82 | 86,5 | 90 | 93,5 |
| Толуен | 26 | 36,5 | 51 | 66,5 |
| Етилацетат | 24,2 | 33,3 | 48,5 | 66,2 |
| Бутанон | 34,6 | 45,7 | 59,2 | 72,9 |
| Циклогексанон | 34,6 | 42,2 | 54,5 | 68,2 |
| Циклогексан | 2 | 2,5 | 7 | 18,5 |
Рідкий капролактам є потужним розчинником для багатьох полярних і неполярних органічних речовин.
Отримання
Як вихідні сполуки для синтезу капролактаму найчастіше застосовуються циклогексанон, циклогексан, фенол, які отримують із бензену, толуену.
Отримання з циклогексанону
Основні методи отримання капролактаму є модифікаціями схеми перетворення циклогексанону в оксим із наступним перегрупуванням:
Процес AlliedSignal
Американською компанією «AlliedSignal» був розроблений метод отримання із виходом продукту близько 98% Гідроксиламін використовується у формі сульфату. Його отримують з оксиду азоту N2O:
Утворений гідроксиламін сульфат бере участь у нейтралізації циклогексанону (1—2):
Побічним продуктом виробництва оксиму є сульфат амонію, його теоретичний вихід знаходиться на рівні 2,9 кг на кілограм цільового продукту. Утворений сульфат амонію надалі можна використовувати як добрива.
У кислому середовищі оксим кількісно піддається перетворенню у капролактам за механізмом перегрупування Бекмана (2—3). Для цього використовують олеум, що також допомагає поглинути небажану вологу з лактаму. У реакційну суміш подається невелика кількість амоніаку для завершення нейтралізації, це призводить до утворення додаткових 1,5 кілограма сульфату амонію на кілограм капролактаму.
Процес BASF
Синтез за методом «BASF» ведеться від отримання циклогексанону шляхом каталітичного окиснення повітрям циклогексану у рідкій фазі до суміші циклогексанон-циклогексанол та наступною дегідрогенізацією у газовій фазі. Вихід варіюється від 75% при ступені перетворенні циклогексану у 10% до 80% при перетворенні у 5%.
Отримання гідроксиламіну у формі змішаного сульфату ведеться гідрогенізацією оксиду азоту(II) над паладієвим каталізатором у присутності сульфатної кислоти:
Метод відзначається меншою кількістю побічних продуктів — 2,4 кг сульфату амонію на кілограм кінцевого продукту, однак він дорожчий через складність процесу гідрогенізації.
Гідроксиламін-фосфатний процес
Компанія «Dutch State Mines» запропонувала варіацію із використанням ортофосфатної кислоти на стадії синтезу гідроксиламіну. Відновлення розчину кислоти і нітрату амонію проводиться воднем на паладієвому каталізаторі:
Після завершення гідрування нітрат-іонів, проводиться додаткова реакція гідроксиламіну із фосфатною кислотою при pH 1,8.
Утворення оксиму із гідроксиламін фосфатом відбувається аналогічно до сульфат-похідної:
Ефективність оксимації сягає 98%, інші ж 2% додатково нейтралізуються гідроксиламіном та амоніаком при pH 4,5 (тоді як основна взаємодія проводиться при pH 2). В подальшому оксим виділяється з розчиннику (толуену) і направляється на стадію проведення перегрупування.
Отримання з циклогексану
У 1950-х роках японським підприємством «Toray Industries» був розроблений спосіб фотооксимації циклогексану: дія ультрафіолетового випромінювання на суміш циклогексану з нітрозил хлоридом та наступне перегрупування в олеумі.
Нітрозил хлорид синтезується з сульфатної кислоти та оксидів азоту, що отримують спалюванням амоніаку:
Фотохімічна взаємодія, яка веде до утворення гідрохлориду оксиму:
Подальше проведення перегрупування в олеумі утворює побічний продукт, сульфат амонію, в кількості 1,7 кг на кілограм капролактаму.
Отримання з толуену
Синтез капролактаму з толуену, розроблений у «Snia Viscosa» (1960), проводиться у три стадії:
- каталітичним окисненням толуену до бензойної кислоти (каталізатор — кобальт, температура 160—170 °C, тиск 0,8-1 МПа, вихід близько 90% від теоретичного):
- гідрогенуванням відділеної перегонкою бензойної кислоти до циклогексанкарбоксильної:
- нітрозодекаброксилюванням циклогексанкарбоксильної кислоти із утворенням капролактаму у присутності олеуму:
В ході останної взаємодії циклогексанон та його оксим утворюються in situ.
Полімеризація
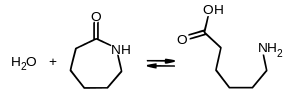
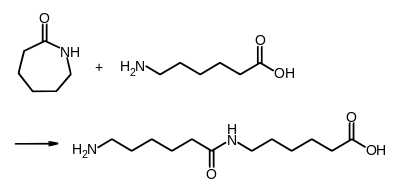
Капролактам здатен полімеризуватися. В результаті гідролізу відбувається розрив кільця із утворенням лінійних мономерів ε-амінокапронової кислоти, що можуть об'єднуватися:
Токсичність
Капролактам є малотоксичною речовиною, при його безпечному використання він не становить загрози для здоров'я. Тривалий контакт із пилом або випаровуваннями капролактаму може завдати пошкоджень очам, слизовим оболонкам, шкірі, в окремих випадках можлива поява респіраторних захворювань. Результатом впливу речовини на шкіру є її почервоніння, грубшання. Загалом, відчуття аналогічні до сонячного опіку.
Для усунення слідів капролактаму достатньою мірою буде вмивання водою, в якій він добре розчинний, за необхідності можна також використати мило.
Застосування
Основним застосуванням капролактаму є використання його як сировини для отримання капрону (нейлону-6) та лізину.
Примітки
- azepan-2-one
- При температурі 80 °C.
- За тиску 101,3 кПа.
- При температурі 20 °C.
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.) (С.?)
- Fisher W. B., Crescentini L. Caprolactam // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 4. — P. 426-432. — ISBN 978-0-471-48517-9. — DOI: (англ.) (С.?)
- Ritz J. et al. Caprolactam // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — 21 p. — DOI: (англ.) (С.?)
- Химический энциклопедический словарь / Под ред. И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.) (С.?)