Гістидин
Гістидин (Кодони: CAU, CAC) — одна з двадцяти стандартних амінокислот, що входять до складу білків.
| L-Гістидин | |
|---|---|
 |
 |
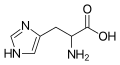
| Назва за IUPAC | Гістидин (His або H) |
| Інші назви | 2-Аміно-3-(1H-імідазол-4-іл)пропанова кислота |
| Ідентифікатори | |
| Номер CAS | 71-00-1 |
| PubChem | 773 |
| Номер EINECS | 200-745-3 |
| DrugBank | DB00117 |
| KEGG | D00032 |
| ChEBI | 57595 |
| SMILES |
O=C(O)[C@@H](N)Cc1cncn1 |
| InChI |
1/C6H9N3O2/c7-5(6(10)11)1-4-2-8-3-9-4/h2-3,5H,1,7H2,(H,8,9)(H,10,11)/t5-/m0/s1 |
| Номер Бельштейна | 84088 |
| Номер Гмеліна | 663322 |
| Властивості | |
| Молекулярна формула | C6H9N3O2 |
| Розчинність (вода) | 4,19 г/100 г при 25 °C [1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
З гістидину в організмі синтезується нейромедіатор гістамін, що є сигнальною сполукою в алергічних процесах.
Біологічна роль
У молекулі гістидину залишок імідазолу містить два атоми азоту, один з яких у водних розчинах має кислотні властивості, а інший — основні, аналогічно до азоту піридину. Така двоїстість хімічних функцій імідазольного рою проявляється в тому, що залишки гістидину у білку можуть утворювати іонні зв'язки як із кислотними групами білка, так й з металами; декотрі з них є обов'язковими компонентами багатьох ферментів. Кислотні групи, які беруть участь в утворенні іонних зв'язків, представлені C-кінцевими карбоксильними групами поліпептидних ланцюжків й вільними карбоксильними групами залишків аспарагінової й глутамінової кислот.