Дихромати
Дихрома́ти, біхрома́ти — солі дихроматної кислоти H2Cr2O7. Більшість дихроматів має помаранчево-червоний колір. Сполуки цього ряду є сильними окисниками.
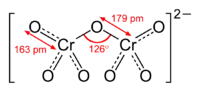
Поширення у природі
У природі дихромати не є розповсюдженими через свою велику хімічну активність. Рідкісним прикладом мінералу дихроматів є лопецит K2Cr2O7.
Фізичні властивості

Усі сполуки ряду дихроматів є кристалами, забарвленими у помаранчевий колір. Більшість дихроматів легкорозчинна у воді, за виключенням сполук деяких важких металів, наприклад, дихромату срібла(I).
Дихромати —— сильнотоксичні речовини, які можуть залишать опіки при контакті зі шкірою.
Отримання
Дихромати отримують підкисленням розчинів хроматів. Приподальшому підкисленні можливе утворення три-, тетра- та поліхроматів із загальною формулою CrnO3n+12-.
Застосовується метод, що полягає в обробці оксиду хрому(VI) сполуками з яскраво вираженими осно́внимим властивостями (концентрованими лугами, осно́вними оксидами та деякими карбонатами):
Також дихромати синтезують дією на CrO3 хроматів:
Хімічні властивості
Дихромати стійкі в кислому середовищі та нестійкі у лужному — під дією гідроксид-іонів вони деградують до хроматів:
Порівняно із хроматам дихромати проявляють сильніші окисні властивості.
При нагріванні розкладаються із утворенням оксиду хрому(III):
Застосування
Найважливішими представниками ряду сполук є дихромат калію (K2Cr2O7) і дихромат натрію (Na2Cr2O7) (хромпіки), що застосовуються в об'ємному аналізі, шкіряній, текстильній та інших галузях промисловості.
Див. також
Джерела
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1966. — Т. 2. — 833 с. (рос.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1972. — Т. 2. — 871 с. (рос.)
- Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
.jpg.webp)
