Дихромат калію
Дихрома́т ка́лію, ка́лій дихрома́т — неорганічна сполука, калієва сіль ряду дихроматів складу K2Cr2O7. Речовина є помаранчево-червоними кристалами із гірким смаком і великою токсичністю. В природі знаходиться у вигляді рідкісного мінералу лопециту. Проявляє сильні окисні властивості.
| Дихромат калію | |
|---|---|
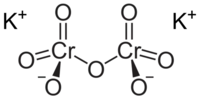 | |
 | |
| Назва за IUPAC | калій дихромат |
| Інші назви | біхромат калію, калій гептаоксидодихромат, хромпік (технічна назва) |
| Ідентифікатори | |
| Номер CAS | 7778-50-9 |
| Номер EINECS | 231-906-6 |
| KEGG | C15227 |
| Назва MeSH | D01.220.150.650 і D01.745.650 |
| ChEBI | 53444 |
| RTECS | HX7680000 |
| SMILES |
[O-][Cr](=O)(=O)O[Cr](=O)(=O)[O-].[K+].[K+][1] |
| InChI |
InChI=1S/2Cr.2K.7O/q;;2*+1;;;;;;2*-1 |
| Властивості | |
| Молекулярна формула | K2Cr2O7 |
| Молярна маса | 294,185 г/моль |
| Зовнішній вигляд | помаранчево-червоні кристали |
| Густина | 2,68 г/см³ |
| Тпл | 398 °C |
| Ткип | ~500 °C (розкл.) |
| Розчинність (вода) | 15,1 г/100 г |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-2033 кДж/моль |
| Ст. ентропія S |
291,2 Дж/(моль·K) |
| Теплоємність, c |
219,7 Дж/(моль·K) |
| Пов'язані речовини | |
| Інші аніони | хромат калію |
| Інші катіони | дихромат натрію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Застосовується у виготовленні піротехніки, сірників, фотоплівки, пігментів і барвників. Як ефективний окисник використовується в органічному синтезі, а також у складі хромової суміші для миття лабораторного посуду.
Фізичні властивості
Дихромат калію добре розчиняється у воді, рідкому діоксиді сірки, фосфорилхлориді POCl3, погано розчиняється в аміаці, у спиртах.
| 0 °C | 10 °C | 20 °C | 25 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4,30 | 7,12 | 10,9 | 13,1 | 15,5 | 20,8 | 26,3 | 31,7 | 36,9 | 41,5 | 45,5 | 48,9 |
За звичайних умов дихромат перебуває в α-модифікації — у вигляді триклинних кристалів. За температури вище 241,6 °C α-модифікація переходить у β-форму (моноклинні кристали).
Отримання
Дихромат калію синтезують взаємодією гарячих концентрованих розчинів хлориду калію і дихромату натрію:
Оскільки дихромат калію є найменш розчинним із солей, що беруть участь в реакції та утворюються, він першим кристалізуватиметься з розчину.
Іншим способом є добування дихромату з хромових руд, що містять оксид хрому(III). На першій стадії метод полягає у прожарюванні суміші оксиду хрому та карбонатом калію (або гідроксидом калію) із доступом кисню:
Згодом утворений хромат калію переводиться у підкислений розчин, де він утворює дихромат:
Хімічні властивості
Дихромат калію калію розкладається при нагріванні вище за 500 °C:
У водних розчинах дихромат частково гідролізується утворюючи іон HCrO4-:
В концентрованих розчинах дихромату калію, доведених до кипіння, утворюються поліхромати складу K2CrnOn+1: трихромат калію K2Cr3O10 і тетрахромат калію K2Cr4O13.
Дихромат калію розкладається концентрованою сульфатною кислотою та галідними кислотами, наприклад, хлоридною:
Частково розкладається лугами:
Дихромат калію є надзвичайно сильним окисником, як у розчинах, так і при спіканні.
Він ефективно окиснює органічні сполуки:
За високих температур дихромат відновлюється алюмінієм, коксом, воднем, а також сіркою:
При взаємодії у кислому розчині із концентрованим пероксидом водню утворюється перекисний координаційний комплекс складу CrO5·H2O, забарвлений у синій колір:
Токсичність
Дихромат калію є надзвичайно токсичною речовиною. Потенційна летальна доза для людини коливається в межах 50—500 мг/кг тіла.
Контакт дихромату зі шкірою може залишать почервоніння, опіки; при його вдиханні з'являється утруднене дихання, кашель, печіння в горлі. Потрапляючи до організму через стравохід дихромат спричинить нудоту, болі в животі, діарею.
У випадку вдихання пари дихромату калію необхідно дати доступ свіжому повітрю, можливо знадобиться проведення штучного дихання. При потраплянні речовини на шкіру і в очі необхідно промити місце великою кількістю води; якщо дихроматом забруднено одяг, його слід зняти і промити шкіру ще раз. Після проковтування дихромату треба промити ротову порожнину і випити кілька склянок води, далі очікувати на медичну допомогу. Забороняється викликати блювоту.[3]
Застосування
Дихромат калію є сильним окисником, тому його широко використовують у виготовленні піротехніки, сірників; він є окисником в органічному синтезі і компонентом так званої хромової суміші, яка застосовується для миття лабораторного посуду.
Дихромат використовується у виробництві фотоплівок, пігментів і барвників, інгібіторів корозії металу.
Примітки
- POTASSIUM DICHROMATE
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Potassium Dichromate — PubChem Compound Database (англ.)
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Lange's Handbook of Chemistry / John A. Dean. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Halstenberg J., Knopf H., Schmidt P. Chromium Сompounds // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 22-23. — DOI: (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / Под ред. В. И. Спицына. — М. : «Мир», 1972. — Т. 2. — 871 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)