Катод
Като́д (грец. χάθοδος (рос. катод, англ. cathode, лат. Kathode f, нім. Katode f) — повернення, хід вниз) — електрод деякого приладу, приєднаний до від'ємного полюса джерела струму.
В електрохімії катод — електрод, до якого в електроліті напрямлений струм (рух додатних частинок). Може мати від'ємну полярність при роботі електрохімічної комірки як споживача енергії: наприклад, при електролітичному рафінуванні металів (міді, нікелю тощо), при електролітичному розкладанні розплавів або розчинів солей, або додатну — при роботі як джерела енергії (гальванічний елемент). У випадку акумулятора можуть виникнути непорозуміння оскільки під час заряджання катодом за таким означенням є від'ємний електрод, а при розряджанні (через змінення напряму струму в електроліті) — додатний (інший).
Катод в електрохімії і кольорової металургії

В електрохімії катод — електрод, на якому відбуваються реакції відновлення. Наприклад, під час електролітичного рафінування металів (міді, нікелю тощо) на катоді осідає очищений метал. Одержуваний метал також називають катодом (катод мідний[1], катод нікелевий, катод цинковий тощо) і використовують для подальшого виготовлення металевої продукції (дроту, фольги, порошку, виробів тощо). Для здирання готового катода з постійної катодної основи використовують катодоздиральні машини.
Катод у вакуумних електронних приладах
У вакуумних електронних приладах катод — електрод, який є джерелом вільних електронів, зазвичай внаслідок термоелектронної емісії. В електронно-променевих приладах катод входить до складу електронної гармати. Для полегшення електронної емісії його, як правило, виготовляють із нанесенням металів з малою роботою виходу електрона і додатково підігрівають. Розрізняють катоди прямого розжарення, де нитка розжарення безпосередньо є джерелом електронів, і непрямого, де катод підігрівається через керамічний ізолятор.
Катод у напівпровідникових приладах
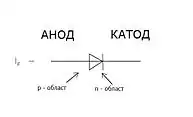
Електрод напівпровідникового приладу (діода, тиристора), підключений до від'ємного полюса джерела струму, коли прилад відкритий (тобто має малий опір), називають катодом, підключений до додатного полюса — анодом.
Знак анода і катода
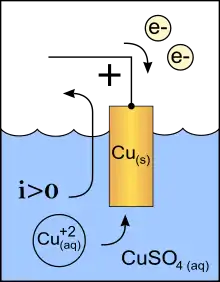
У літературі зустрічаються різні позначення знака катода — «−» або «+», що визначається, зокрема, особливостями описуваних процесів. У електрохімії прийнято вважати, що «−» катод — електрод, на якому відбувається процес відновлення, а «+» анод — той, де проходить процес окислення[2][3]. Під час роботи електролізера (наприклад, під час рафінування міді) зовнішнє джерело струму забезпечує на одному з електродів надлишок електронів (від'ємний заряд), тут відбувається відновлення металу, це катод. На іншому електроді забезпечується нестача електронів і окислення металу, це анод. Разом з тим, під час роботи гальванічного елемента (наприклад, мідно-цинкового), надлишок електронів (і від'ємний заряд) на одному з електродів забезпечується не зовнішнім джерелом струму, а власне реакцією окислення металу (розчинення цинку), тобто в гальванічному елементі від'ємним, якщо дотримуватися наведеного визначення, буде анод. Електрони, проходячи через зовнішнє коло, витрачаються на проходження реакції відновлення (міді), тобто катодом буде додатний електрод. Так, на наведеній ілюстрації зображено позначений знаком «+» катод гальванічного елемента, на якому відбувається відновлення міді. Відповідно до такого тлумачення, для акумулятора знак анода і катода змінюється залежно від напрямку протікання струму.[3][4][5].
В електротехніці за напрямок струму прийнято вважати напрямок руху додатних зарядів, тому у вакуумних і напівпровідникових приладах і електролізних комірках струм тече від додатного анода до від'ємного катода, а електрони, відповідно, навпаки, від катода до анода.
Див. також
Примітки
- ГОСТ 546—2001 Катоды медные. Технические условия
- Антропов Л. И. Теоретическая электрохимия: Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный: Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Джерела
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов[недоступне посилання з липня 2018]
- Знаем ли мы, что такое АНОД и что такое КАТОД? — Теория, измерения и расчеты.
- Катод // Казахстан. Національна енциклопедія. — Алмати : Қазақ энциклопедиясы, 2005. — Т. III. — ISBN 9965-9746-4-0.