Катумаксомаб
Катумаксомаб [1] (торгова назва Removab) - гібридне моноклональне антитіло щурів-мишей, яке використовується для лікування злоякісного асциту, стану, що виникає у людей з метастазуючим раком. Він зв'язується з антигенами CD3 та EpCAM. Розроблений компанією Fresenius Biotech та Trion Pharma (Німеччина).
Медичне використання
Препарат використовується для лікування злоякісного асциту у людей з EpCAM-позитивним раком, якщо стандартна терапія відсутня. [2] [3] Асцит - це скупчення рідини в порожнині очеревини.
Звичайним лікуванням злоякісного асциту є прокол очеревини, для витікання накопиченої рідини. Після пункції катумаксомаб вводять шляхом внутрішньочеревної інфузії. Процедуру повторюють чотири рази протягом приблизно одинадцяти днів. Було показано, що при такому лікуванні виживання без пункції можна збільшити з 11 до 46 днів. [4]
Побічні ефекти
Часті побічні ефекти включають гарячку, нудоту та блювоту. Перед застосуванням катумаксомабу гарячку та біль слід контролювати, даючи НПЗЗ, анальгетики або жарознижуючі засоби. [5] У ході досліджень усі побічні ефекти були повністю оборотними. Більшість було викликано вивільненням цитокінів.[2]
Механізм дії
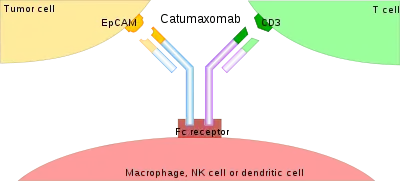
Багато видів ракових клітин несуть на своїй поверхні EpCAM (молекулу адгезії епітеліальних клітин). Зв’язуючись з такою клітиною одним кінцем, з Т-лімфоцитом через інший кінець і з антигенпрезентуючою клітиною (макрофаг, натуральний кілер або дендритна клітина) через важкі ланцюги антитіла, запускається імунологічна реакція проти ракової клітини. Видалення ракових клітин з черевної порожнини зменшує пухлинне навантаження, що розглядається як причина асциту у людей з раком. [2] [6] [7]
Хімічна будова
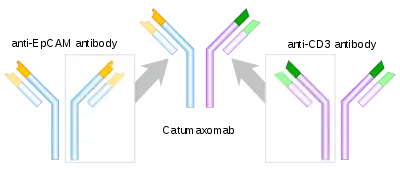
Катумаксомаб складається з однієї «половини» (один важкий ланцюг та один легкий ланцюг) антитіла проти EpCAM та однієї половини антитіла проти CD3, так що кожна молекула катумаксомабу може зв’язувати як EpCAM, так і CD3. Крім того, Fc-ділянка може зв'язуватися з рецептором Fc на клітинах. Через це препарат називають трифункціональним антитілом .
Історія
Катумаксомаб був розроблений компанією Trion Pharma на основі попередньої роботи Мюнхенкського центру Гемгольца. Першим винахідником зазначений доктор Хорст Ліндхофер. [8] Компанія Fresenius Biotech провела клінічні випробування та подала препарат на затвердження до Європейського агентства з лікарських засобів (EMA). Він був затверджений у ЄС 20 квітня 2009 р.[9] У 2013 році катумаксомаб був добровільно вилучений з ринку США, а в 2017 році - з ринку ЄС з комерційних причин. [10] Продукт не продавався в ЄС з 2014 року [11]
Посилання
- Catumaxomab: clinical development and future directions. mAbs 2 (2): 129–36. 2010. PMC 2840231. PMID 20190561. doi:10.4161/mabs.2.2.11221. Проігноровано невідомий параметр
|vauthors=(довідка) - European Public Assessment Report for March 2009. European Medicines Agency. March 2009.
- The trifunctional antibody catumaxomab for the treatment of malignant ascites due to epithelial cancer: Results of a prospective randomized phase II/III trial. International Journal of Cancer 127 (9): 2209–21. November 2010. PMC 2958458. PMID 20473913. doi:10.1002/ijc.25423. Проігноровано невідомий параметр
|vauthors=(довідка) - The evolving role of catumaxomab in gastric cancer. Expert Opinion on Biological Therapy 8 (9): 1407–15. September 2008. PMID 18694358. doi:10.1517/14712598.8.9.1407. Проігноровано невідомий параметр
|vauthors=(довідка) - Neue Arzneimittel. 2009.
- Capital Market Day Fresenius Biotech: Fresenius concentrates biotechnology activities on antibody and innovative cell therapies. Fresenius SE. Архів оригіналу за 26 серпня 2010.
- Characterisation of the new EpCAM-specific antibody HO-3: implications for trifunctional antibody immunotherapy of cancer. British Journal of Cancer 97 (3): 315–21. August 2007. PMC 2360319. PMID 17622246. doi:10.1038/sj.bjc.6603881. Проігноровано невідомий параметр
|vauthors=(довідка) - , "Use of Trifunctional Bispecific and Trispecific Antibodies for the Treatment of Malignant Ascites"
- TRION Pharma: Trifunctional Antibody Catumaxomab Kills Cancer Stem Cells. Архів оригіналу за 13 липня 2011. Процитовано 19 листопада 2009.
- Neovii completes marketing authorisation withdrawal of Removab in the European Union. Neovii Biotech GmbH.
- Removab: Withdrawal of the marketing authorisation in the European Union. European Medicines Agency. 10 липня 2017.