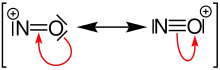
Нітрозоній
Нітрозо́ній (також нітрози́л, англ. nitrosonium) — катіон зі структурною формулою [NO]+. Формально є катіоном моноксиду азоту.
Одержання
Джерелом катіонів нітрозонію зазвичай є сполуки, що вже містять нітрозоній у своєму складі, напр. хлорид нітрозонію, нітрозилсульфатна кислота, або ж тетрафтороборат нітрозонію.
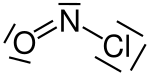 Структурна формула хлориду нітрозонію
Структурна формула хлориду нітрозонію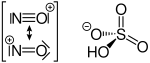 Структурна формула нітрозилсульлфатної кислоти
Структурна формула нітрозилсульлфатної кислоти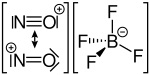 Структурна формула тетрафтороборату нітрозонію
Структурна формула тетрафтороборату нітрозонію
Однак, ці сполуки (і, відповідно, нітрозоній) також можна отримати in situ шляхом реакції нітриту натрію з відповідною мінеральною кислотою: В кислому середовищі нітрит-аніони протонуються до нітритної кислоти, а при подальшому протонуванні утворюється катіон нітрозонію:[1]

Хімічні властивості
Гідроліз
Нітрозоній утворює з водою нітритну кислоту:
З цієї причини нітрозонієвмісні речовини мають зберігатись в безводних умовах. У присутності основи нітрозоній утворює нітрит-аніон:
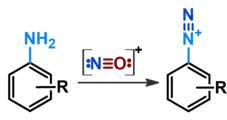
Діазотування
Нітрозоній є ключовим реагентом при утворенні діазосполук з ароматичними або аліфатичними амінами. Найбільше значення має реакція з ароматичними амінами — діазотування:
Окисно-відновні властивості
Нітрозоній (наприклад, у формі твердого NOBF4) є сильним окисником:[2]
- У дихлорометані він має редокс-потенціал 1.00 V проти фероцену (1.46–1.48 V проти каломельного електроду);
- В ацетонітрилі редокс-потенціал складає 0.87 V проти фероцену (1.27–1.25 V проти каломельного електроду).
Продуктом редокс-реакції є NO, що може бути легко виведений з реакційної суміші потоком азоту. Важливо відмітити, що NO в присутності кисню повітря легко окислюється до NO2, який може спричинити побічні реакції; тому, присутність NO в реакції має бути зведена до мінімуму.
Нітрозилювання аренів
Електрононадлишкові арени (наприклад, анізол) можуть утворювати нітрозосполуки з NO+:
Нітрозильні комплекси металів
Нітрозоній реагує з деякими карбонільними комплексами і утворює відповідні нітрозильні комплекси:[3]
Див. також
Примітки
- Becker, Heinz G. O. 1922-2017. Organikum organisch-chemisches Grundpraktikum (вид. 21., neu bearb. und erw. Aufl). Weinheim. ISBN 978-3-527-29985-0. OCLC 52657057.
- N. G. Connelly, W. E. Geiger (1996). Chemical Redox Agents for Organometallic Chemistry. Chem. Rev. 96 (2): 877–910. PMID 11848774. doi:10.1021/cr940053x.
- T. W. Hayton, P. Legzdins, W. B. Sharp. "Coordination and Organometallic Chemistry of Metal-NO Complexes". Chemical Reviews 2002, volume 102, pp. 935–991.