Діазотування
Діазотува́ння (англ. diazotation, diazoniation, або diazotization) — тип реакцій в органічній хімії, які відбуваються між первинними ароматичними амінами й реагентами, які містять у своїй структурі або можуть звільнювати катіон нітрозонію в якості реактивної компоненти. Продуктами реакції є т. зв. діазосполуки (що є, технічно, арилдіазонієвими солями); ці сполуки є дуже популярними реагентами в сучасній хімії через їхню високу схильність до відщеплення молекулярного азоту, в результаті чого — в залежності від умов — утворюються арильні радикали або "арильні катіони".
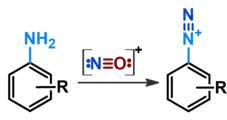
Зазвичай в якості джерела катіонів нітрозонію використовується розчин нітриту натрію в мінеральній кислоті, але застосування також знайшли й естери неорганічних кислот (як-от амілонітрит); в останньому випадку реакцію називають "діазотування за Кньовенагелем"[1]. Через нестабільність інтермедіатів і продуктів реакції діазотування завжди проводять при охолодженні щонайменш у льодяній бані (0 °С).
Нітрозоній, що по собі є електрофілом, здатен утворювати діазосполуки з іншими молекулами (наприклад, з аліфатичними амінами або похідними амінокислот). Однак, "діазотуванням" називають саме реакцію з первинними ароматичними амінами.
Механізм реакції
В кислому середовищі нітрит-аніон протонується, утворюючи нітритну кислоту. При повторному протонуванні можливе відщепленні молекули води, що призводить до утворення катіону нітрозонію:

В залежності від того, яку кислоту використовувати, можна отримати розчин хлориду (броміду) нітрозонію, нітрозилсульфатної кислоти, або ж тетрафтороборату нітрозонію.
При додаванні в реакційну суміш ароматичного аміну (в якості прикладу нижче наведений анілін) катіон нітрозонію атакує аміногрупу. Після відщеплення протону утворюється нітрозамін, а подальша черга рівноважних реакцій протонування-депротонування призводить до фінального відщеплення молекули води й утворення солі арилдіазонію (діазосполуки):

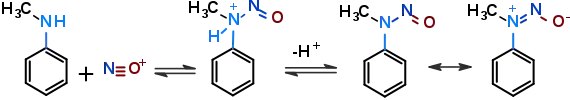
У випадку вторинних амінів реакція закінчується на стадії нітрозамінів:[2]
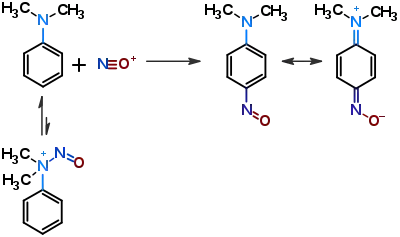
А у випадку третинних амінів замість приєднання нітрозонію до аміногрупи відбувається електрофільне ароматичне заміщення з утворенням пара-нітрозоаніліну:
Загальні методики діазотування
Оскільки ароматичні аміни мають значно нижчі значення pKa, аніж аліфатичні аміни, успішний перебіг реакції діазотування вимагає присутності надлишку кислоти; при цьому, чим менш основний амін, тим сильнішою має бути кислота. Загалом розрізняють дві класичні методики:[2]
Діазотування нітритом натрію
Це є "класична" процедура, що працює з багатьма ароматичними амінами. Для найкращого перебігу реакції всі тверді речовини мають бути ретельно перетерті в ступці.
При охолодженні в водяній бані x моль аміну порціями розчиняють в 2.5–3х моль напіврозбавленої (~18-20%) хлоридної кислоти або ~30% сульфатної кислоти; при цьому температура суміші не має перевищувати 50°С. Якщо амін не розчиняється повністю, то реакцію проводять в суспензійному вигляді при дуже інтенсивному перемішуванні. Далі, суміш охолоджують до 0°С (в льодяно-соляній бані) і по краплям додають x моль 2.5М розчину нітриту натрію в воді. При цьому треба не допускати локального нагрівання вище 5°С й виділення діоксиду азоту. По закінченні докрапування суміш мішають 10-15 хвилин, а потім перевіряють наявність нітритної кислоти йодним папірцем. У випадку негативної реакції додають ще трошки розчину нітриту натрію й мішають суміш наступні 5–10 хв, з подальшою перевіркою йодним папірцем. Цю процедуру повторюють, допоки йодний тест не буде давати стабільний позитивний результат через 15 хвилин після додавання останньої порції нітриту натрію. Надлишок нітритної кислоти нейтралізують додаванням невеликої порції сечовини або сульфамідної кислоти («на кінчику шпателя») й перемішуванням протягом 30 хв.
Діазотування нітрозилсульфатною кислотою
У випадку дуже слабоосновних амінів перший метод може не спрацювати. Тому в якості розчинника обирають концентровану (>90%) сульфатну кислоту, в яку при охолодженні повільно додають перетертий в ступці нітрит натрію. При цьому запобігають локальне нагрівання вище 10°С й виділення діоксиду азоту. По закінченні додавання суміш мішають 10 хв. при 15–20°С; при неповному розчиненні нітриту натрію суміш нагрівають до 70°С. Потім, до суміші повільно додають амін при 10–20°С й мішають протягом трьох годин при 20°С. Надлишок нітритної кислоти нейтралізують сечовиною чи сульфамідною кислотою.
Ризики й небезпеки
Отриманий розчин діазосполуки використовують для подальшої запланованої реакції або ж осаджають діазосполуку шляхом додавання абсолютного етанолу чи ацетату амонію. Слід, однак, зазначити, що діазосполуки в твердому сухому стані дуже чутливі до удару й можуть спонтанно детонувати. Тому, наприклад, хлориди арилдіазонієвих солей ніколи не осаджають. З іншого боку, діазосполуки в розчині схильні до утворення пересичених розчинів; відомі випадки отримання тяжких травм або навіть смерті через спонтанну кристалізацію з розчину та, як наслідок, детонацію діазосполук.[3]
Тому, безпечнішим методом є отримання тетрафтороборатів арилдіазонієвих солей. Для цього амін розчиняють/суспензують в 40-50%ній водній тетрафтороборній кислоті й продовжують синтез за першим методом. Утворені діазосполуки випадають у вигляді осаду і є набагато безпечнішими за хлориди. Альтернативним методом є додавання тетрафтороборату натрію до реакційної суміші, що містить хлорид арилдіазонію.
Діазотування за Кньовенагелем
Цей тип реакції був відкритий Емілем Кньовенагелем у 1890 році. В якості джерела нітрозонію використовуються естери нітритноїї кислоти, найпоширенішим представником яких є амілонітрит. Механізм діазотування за Кньовенагелем представлено нижче:

Великою перевагою цього методу є можливість ізолювання безводних арилдіазонієвих солей. Так, за стандартною процедурою амін розчиняють в льодяній оцтовій кислоті і при охолодженні додають розчин амілонітриту в етері.[4] Для отримання безводних тетрафтороборатів арилдіазонію в реакцію додають надлишок .[5]
Див. також
Примітки
- Knoevenagel Diazotization Method. Comprehensive Organic Name Reactions and Reagents (англ.). American Cancer Society. 2010. с. 1627–1630. ISBN 978-0-470-63885-9. doi:10.1002/9780470638859.conrr362.
- Becker, Heinz G. O. 1922-2017. Organikum organisch-chemisches Grundpraktikum (вид. 21., neu bearb. und erw. Aufl). Weinheim. ISBN 978-3-527-29985-0. OCLC 52657057.
- Sheng, Min; Frurip, Dave; Gorman, Dave (1 листопада 2015). Reactive chemical hazards of diazonium salts. Journal of Loss Prevention in the Process Industries (англ.) 38. с. 114–118. ISSN 0950-4230. doi:10.1016/j.jlp.2015.09.004.
- Hantzsch, A.; Jochem, E. (1901-10). Zur Zersetzung der Diazoniumsalze durch Alkohole. Berichte der deutschen chemischen Gesellschaft 34 (3). с. 3337–3343. ISSN 0365-9496. doi:10.1002/cber.19010340316.
- Doyle, Michael P.; Bryker, William J. (1979-04). Alkyl nitrite-metal halide deamination reactions. 6. Direct synthesis of arenediazonium tetrafluoroborate salts from aromatic amines, tert-butyl nitrite, and boron trifluoride etherate in anhydrous media. The Journal of Organic Chemistry 44 (9). с. 1572–1574. ISSN 0022-3263. doi:10.1021/jo01323a048.