Окиснення за Сверном
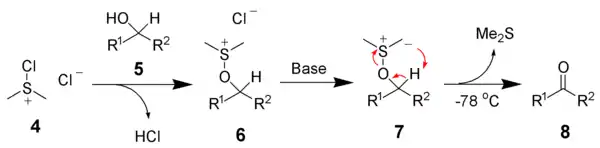
Оки́снення за Све́рном — хімічна реакція, під час якої первинний або вторинний спирт окиснюється до альдегіду або кетону при дії оксалілхлориду, диметилсульфоксиду (ДМСО) та органічної основи, наприклад триетиламіну[1][2][3]. Реакція широко використовується в органічному синтезі через досить м'які умови і може проводитись за присутності багатьох функціональних груп[4][5][6][7].
Реакція названа в честь американського хіміка Даніела Сверна (1916–1982).
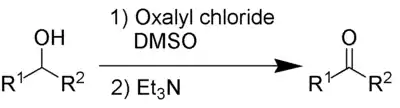
Іншими продуктами реакції є диметилсульфід (Me2S), монооксид Карбону СО, діоксид Карбону CO2 і триетиламоній хлорид (Et3NHCl, якщо як основа використовується триетиламін (Et3N). Оскільки диметилсульфід та монооксид Карбону є токсичними сполуками, реакцію слід проводити від витяжною шафою.
Механізм
Першим етапом окиснення за Сверном є низькотемпературна реакція диметилсульфоксиду 1а, або ж його резонансної структури 1b, з оксилілхлоридом 2. Перший інтермедіат 3 швидко розкладається з вивільненням СО2, СО та утворенням диметилхлоросульфонію хлориду 4.
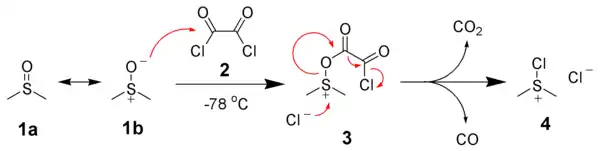
При додаванні спирту 5 диметилхлоросульфоній хлорид 4 реагує з ним з утворенням ключового інтермедіату — алкоксисульфонієвого іону 6. Додавання мінімум 2 еквівалентів основи (зазвичай триетиламіну) призводить до депротонування алкоксисульфонієвого іону 6 і утворення іліду 7. У п'ятичленному циклі перехідного стану Сульфурний ілід 7 розкладається до диметилсульфіду та бажаного кетону або альдегіду 8.
Варіації
При використанні оксалілхлориду як зневоднюючого агенту реакцію слід проводити при температурі нижче −60 °C для уникнення побічних реакцій. При використанні ціанурхлориду або трифлуорооцтового ангідриду замість оксалілхлориду, реакційну суміш можна нагрівати до −30 °C без протікання побічних реакцій. Іншим методом активування ДМСО з ініціюванням утворення інтермедіату 6 є використання карбодіімідів (окиснення Прітцнера–Моффата) або комплексу піридин-триоксид Сульфуру (окиснення Паріка-Доерінга). Інтермедіат 4 можна також отримати з диметилсульфіду та N-хлоросукциніміду (окиснення за Корі-Кімом).
У деяких випадках використання триетиламіну як основи може призводити до епімеризації Карбону в альфа-положенні до утвореної карбонільної групи. Зменшити швидкість протікання цієї побічної реакції можна використовуючи об'ємніші основи, наприклад диізопропілетиламін (iPr2NEt, основа Хюніґа).
Див. також
- Окиснення Паріка-Доерінга
- Окиснення Прітцнера–Моффата
- Окиснення за Корі-Кімом
- Перйодат Деса-Мартіна
Примітки
- Omura, K.; Swern, D. (1978). Oxidation of alcohols by "activated" dimethyl sulfoxide. A preparative, steric and mechanistic study. Tetrahedron 34 (11): 1651. doi:10.1016/0040-4020(78)80197-5.
- Mancuso, A. J.; Brownfain, D. S.; Swern, D. (1979). Structure of the dimethyl sulfoxide-oxalyl chloride reaction product. Oxidation of heteroaromatic and diverse alcohols to carbonyl compounds. J. Org. Chem. 44 (23): 4148–4150. doi:10.1021/jo01337a028.
- Mancuso, A. J.; Huang, S.-L.; Swern, D. (1978). Oxidation of long-chain and related alcohols to carbonyls by dimethyl sulfoxide "activated" by oxalyl chloride. J. Org. Chem. 43 (12): 2480–2482. doi:10.1021/jo00406a041.
- Dondoni, A.; Perrone, D. (2004). Synthesis of 1,1-Dimethyl Ethyl-(S)-4-formyl-2,2-dimethyl-3-oxazolidinecarboxylate by Oxidation of the Alcohol. Org. Synth.: 320. Проігноровано невідомий параметр
|prep=(довідка); Проігноровано невідомий параметр|vol=(довідка) - Bishop, R. (1998). 9-Thiabicyclo[3.3.1]nonane-2,6-dione. Org. Synth.: 692. Проігноровано невідомий параметр
|prep=(довідка); Проігноровано невідомий параметр|vol=(довідка) - Leopold, E. J. (1990). Selective hydroboration of a 1,3,7-triene: Homogeraniol. Org. Synth.: 258. Проігноровано невідомий параметр
|prep=(довідка); Проігноровано невідомий параметр|vol=(довідка) - Tojo, G.; Fernández, M. (2006). Oxidation of alcohols to aldehydes and ketones: A guide to current common practice. Springer. ISBN 0-387-23607-4.
Посилання
- Окиснення за Сверном на сайті www.organic-chemistry.org.(англ.)
Джерела
- Clayden J., Greeves N., Warren S. Organic chemistry. — 2nd ed. — Oxford University Press, 2012. — P. 667-668. — ISBN 978-0-19-927029-3.
