Іліди
Ілі́ди (англ. ylides) — сполуки із загальною формулою RmX+–Y-Rn. Іліди мають позитивний заряд на атомі X+ (зазвичай, це атоми азоту, фосфору або сірки) та негативний заряд на сусідньому до нього атомі Y- (в більшості випадків, це вуглець, але є й виключення). Таким чином, іліди можна віднести до сполук із цвітер-іонним характером.[1] Іліди не слід плутати з, наприклад, етилідами (англ. ethylides) й ацетилідами (англ. acetylides), в яких негативний заряд не має ковалентного зв'язку з позитивним зарядом.
Класифікація й номенклатура
В залежності від того, який елемент стоїть на місці атома X+, а також які зв'язки він утворює з іншими замісниками, іліди можуть біти віднесені до одного з трьох класів:
- 1,2-диполі з формулою RmX+–Y-R'n. Звичайними представниками є іліди елементів першого періоду.
- 1,2-диполі елементів другого, третього і т. д. періодів, які спроможні до ілід-іленової таутомерії: RmX+–Y-R'n ↔ RmX=YR'n
- 1,3-диполі, в яких X+ зв'язаний ненасиченим зв'язком із іншим атомом Z. У такому випадку теж можлива таутомерія: Z=X+–Y-R'n ↔ Z--X+=YR'n. Такі сполуки можуть вступати в реакції 1,3-диполярного циклоприєднання.
Якщо R' = EWG (електроноакцепторна група), то негативний заряд отримує певну стабілізацію, й у такому випадку іліди називають стабілізованими. Їхня реакційноздатність дещо нижче, аніж в ілідів з алкільними замісниками.
Номенклатура ілідів заснована на назві елемента, що представляє X+; так, у літературі часто зустрічаються іліди фосфору, сірки, азоту й кисню. Більш детальна специфікація передбачає вживання систематичних назв фрагментів RmX після слова "ілід". Іліди азоту, таким чином, можна поділити на:
- Іліди амінів R3N+–C-R2
- Іліди азометинів R2С=N+R–C-R2
- Іліди нітрилів RС≡N+R–C-R2 (до цього класу також відносяться нітриліміди).
Часто також зустрічається номенклатура, в якій підкреслюється позитивний заряд на відповідному атомі, в результаті чого іліди фосфору, сірки, азоту й кисню стають ілідами фосфонію, сульфонію, амонію й оксонію.
Іліди, в яких Y є термінальним атомом, тобто іліди типу RmX+–Y- ↔ RmX=Y, зазвичай називають шляхом поєднання систематичної назви фрагменту RmX із закінченням відповідно до природи Y (оксид, селенід, сульфід, телурид, імід тощо);[1] наприклад, диметилсульфоксид, трифенілфосфаноксид.
Іліди фосфонію
Іліди фосфонію — стабільні, але реактивні сполуки. Вони можуть бути представлені у двох резонансних формах (на прикладі метилентрифенілфосфорану):
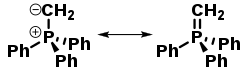 | |
|---|---|
| Ілід | Ілен (фосфоран) |
Однак, ЯМР-спектроскопічні (1H, 13C, 31P)[2] й теоретичні[3] дослідження підтверджують переважний внесок форми іліду, в той час як внесок іленової таутомерної форми в конфігурацію сполуки незначний.
Іліди фосфонію зазвичай отримують шляхом депротонування фосфонієвих солей. Зазвичай це алкілтрифенілфосфонієві галіди, які, в свою чергу, є продуктами взаємодії трифенілфосфану й алкілгалогеніду, який може вступати в SN2-реакції.

Оскільки фосфонійгалогеніди є дуже слабкими кислотами, для їх депротонування необхідні сильні основи, такі як KOtBu, LDA або NaHMDS.
Основною сферою застосування ілідів фосфонію є реакція Віттіга. Зазвичай іліди не ізолюють, а їхній синтез проводять або в присутності потрібної оксосполуки, або ж додають останню одразу після утворення іліду.
Іліди сульфонію
Серед ілідів сульфонію найбільше значення мають диметилсульфонійметилід і диметилсульфоксонійметилід. Їх отримують шляхом депротонування відповідних сульфонієвих солей, які є комерційно доступними:[4]
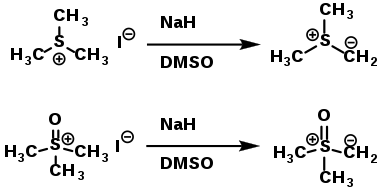 |
Диметилсульфонійметилід |
| Диметилсульфоксонійметилід
(Стабілізований ілід) |
Як і фосфонієві іліди, іліди сульфонію реагують з оксосполуками. Однак, у той час як реакція Віттіга проходить через чотирьохчленний перехідний стан з подальшим елімінуванням, у випадку сульфонієвих ілідів механізм являє собою нуклеофільне приєднання до оксогрупи:

У реакціях з оксосполуками усі іліди сульфонію утворюють епоксиди. Однак, у реакціях з α,β-ненасиченими оксосполуками реактивність діалкільних ілідів та стабілізованих ілідів значно відрізняється; так, буде завжди утворювати епоксиди з оксогрупою, в той час як стабілізовані іліди будуть переважно реагувати з подвійним зв'язком до циклопропанів:
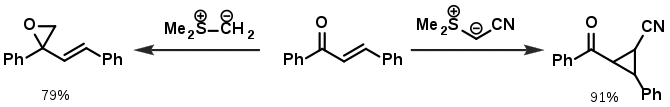
З точки зору механізму, епоксиди є кінетичними продуктами реакції (тобто їх утворення проходить швидко, але є оборотним), у той час як циклопропани є термодинамічними продуктами (утворюютьтся повільно, але більше не розпадаються).[4] Також можна пояснити це з точки зору теорії ТМКО: є "жорстким" нуклеофілом, тому переважно атакує "жорстку" оксогрупу, а стабілізовані іліди дещо більш "м'які", тому віддають перевагу подвійному зв'язку.
Утворення ілідів шляхом взаємодії з карбенами
Іліди можуть виникати в результаті взаємодії карбенів з атомами, що мають вільну електронну пару (азот, кисень, галогени тощо):

Якщо гетероатом (у випадку схеми зверху це Оксиген) пов'язаний подвійним зв'язком з іншим замісником, то такі іліди можуть вступати в реакції 1,3-диполярного циклоприєднання:[5]

Якщо ж усі зв'язки з гетероатомом насичені, то можливий 2,3-сигматропний зсув:[6]
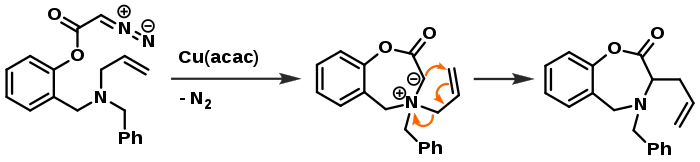
Примітки
- IUPAC - ylides (Y06728). goldbook.iupac.org. Процитовано 10 січня 2020.
- Schmidbaur, Hubert; Buchner, Wolfgang; Scheutzow, Dieter (1973-04). 1H-,13C- und31P-NMR-Daten des Trimethylmethylenphosphorans. Chemische Berichte 106 (4). с. 1251–1255. ISSN 0009-2940. doi:10.1002/cber.19731060421.
- Streitwieser, Andrew; Rajca, Andrzej; McDowell, Robert S.; Glaser, Rainer (1987-07). Semipolar phosphorus-oxygen and phosphorus-carbon bonds. A theoretical study of hypophosphite and related methylenephosphoranes. Journal of the American Chemical Society 109 (14). с. 4184–4188. ISSN 0002-7863. doi:10.1021/ja00248a010.
- Carey, Francis A. (2013). Advanced Organic Chemistry : Part B: Reactions and Synthesis.. Springer. ISBN 978-1-4757-1821-8. OCLC 1066185520.
- Padwa, Albert.; Carter, Stephen P.; Nimmesgern, Hildegard.; Stull, Paul D. (1988-04). Rhodium(II) acetate induced intramolecular dipolar cycloadditions of o-carboalkoxy-.alpha.-diazoacetophenone derivatives. Journal of the American Chemical Society 110 (9). с. 2894–2900. ISSN 0002-7863. doi:10.1021/ja00217a033.
- Clark, J. Stephen; Middleton, Mark D. (2002-03). Synthesis of Novel α-Substituted and α,α-Disubstituted Amino Acids by Rearrangement of Ammonium Ylides Generated from Metal Carbenoids. Organic Letters 4 (5). с. 765–768. ISSN 1523-7060. doi:10.1021/ol017240j.