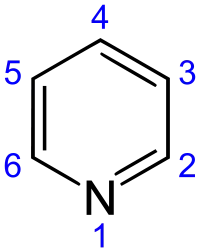
Піридин
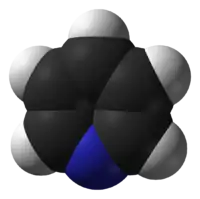
Піриди́н — шестичленний гетероцикл з одним атомом Нітрогену. Безбарвна рідина з характерним неприємним запахом. Без обмежень змішується з водою та практично з усіма органічними розчинниками. З водою (41,3 мас%) утворює азеотропну суміш з температурою кипіння 93,6 °C. Вперше піридин був отриманий з фракцій кам'яновугільної смоли, але наразі практично весь промисловий обсяг піридину виробляється синтетично, — взаємодією оцтового альдегіду, формальдегіду та аміаку.
| Піридин | |
|---|---|
 | |
 | |
| Ідентифікатори | |
| Номер CAS | 110-86-1 |
| PubChem | 1049 |
| Номер EINECS | 203-809-9 |
| KEGG | C00747 |
| ChEBI | 16227 |
| RTECS | UR8400000 |
| SMILES |
c1ccncc1 |
| InChI |
1/C5H5N/c1-2-4-6-5-3-1/h1-5H |
| Номер Бельштейна | 103233 |
| Номер Гмеліна | 1996 |
| Властивості | |
| Молекулярна формула | C5H5N |
| Молярна маса | 79,1 |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 0,982 |
| Тпл | −41,7 |
| Ткип | 115,3 |
| Тиск насиченої пари | 18 мм рт. ст. |
| Кислотність (pKa) | 5,25[1][2] |
| Показник заломлення (nD) | 1,5093 |
| В'язкість | 0,0088 Пуаз |
| Дипольний момент | 2,2 Д[3] |
| Небезпеки | |
| Класифікація ЄС | |
| R-фрази | R20
R21 R22R34R36/37R37 |
| NFPA 704 |
 3
3
0
|
| Температура спалаху | 21 °C |
| Пов'язані речовини | |
| Інші (аміни) | пінаколін хінолін |
| Пов'язані речовини | анілін піримідин піперидин |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Піридин чудовий розчинник, особливо для процесів за участю неорганічних солей та для екстракції антибіотиків. Однак головним чином піридин є сировиною для виробництва лікарських засобів, гербіцидів, інсектицидів та інших агрохімічних препаратів.
Безпека
Піридин токсичний, діє на нервову систему, шкіру. За деякими даними, піридин викликає імпотенцію та безплідність у чоловіків.
Одна людина померла після випадкового прийому півсклянки піридину[4].
Хімічні властивості
Електрофільне заміщення в піридиновому ядрі
Ароматичне ядро піридину збідненне електронами й важко вступає в реакції електрофільного заміщення. Типові реакції електрофільного заміщення (нітрування, заміщення по Фріделю-Крафтсу, сульфування) провести в незаміщеному піридині надзвичайно важко оскільки електрофіли реагують по атому нітрогену ще більш деактивуючи кільце. Скажімо при спробі прямого сульфування піридину він протонується і утворена сіль реагує тільки при температурах близько 320 °C утворюючи 3-сульфопіридин.[5]. Також в третє положення відбувається й бромування піридину в сірчаній кислоті при 130 °C.
Нуклеофільне заміщення в піридиновому ядрі
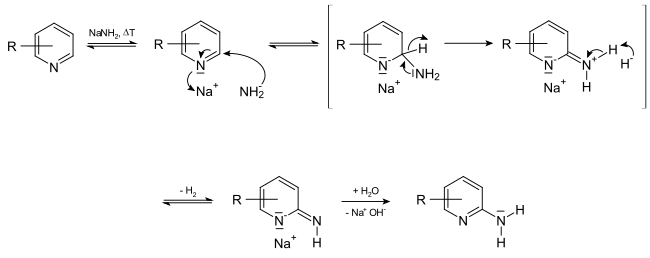
Збіднене електронами ароматичне кільце піридину відносно легко приєднує аніонні нуклеофіли по позиціях 2- та 4-. Заміщення атомів гідрогену в самому піридині проходить відносно непросто оскільки гідрид-аніон є поганою відхідною групою, але атоми галогенів в положеннях 2 чи 4 можуть бути легко заміщені сильними нуклеофілами типу тіолів чи третинних амінів. Однією з небагатьох важливих реакці нуклеофільного заміщення в незаміщеному піридині є реакція Чічібабіна:
Реакції по атому Нітрогену
Атом Нітрогену в піридині має неподілену пару електронів і проявляє основні та нуклеофільні властивості. Він протонується кислотами (pKa спряженої кислоти у водних розчинах 5,25), а також приєднує інші електрофільні сполуки (кислоти Льюїса)
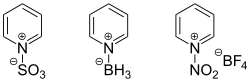
:
- C5H5N + HCl → C5H5NH+Cl-
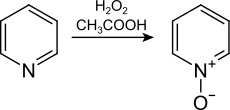
Піридин можна окислити в піридин-N-оксид при дії пероксикислот чи кислоти Каро[6].
Реагує зі сильними кислотами з утворенням піридинових солей
- Файл:Gwewgweggwwegweg.tif
Піридин реагує з метилйодидом за механізмом, утворюючи амонієву сіль.
- Файл:Uu66jj65.tif
Див. також
Гідрування та відновлення
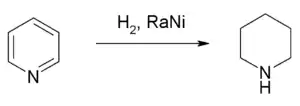
Гідрування піридину в присутності нікелю Ренея дозволяє отримати піперидин.[7]
Часткове гідрування під дією літійалюмогідриду дає суміш ізомерних дигідропіридинів.[8] Селективно 1,4-дигідропіридин можна отримати відновленням піридину певними комплексами магнію й цинку.[9]
Примітки
- Linnell, Robert (1960). Journal of Organic Chemistry 25 (2): 290. doi:10.1021/jo01072a623.
- Pearson, Ralph G.; Williams, Forrest V. (1953). Journal of the American Chemical Society 75 (13): 3073. doi:10.1021/ja01109a008.
- RÖMPP Online – Version 3.5. Thieme Chemistry (Stuttgart: Georg Thieme). 2009.
- Pyridine" (PDF). IARC Monographs 77 (Англійська). Washington DC: OSHA. 1985.
- O. Fischer: Notiz über Nikotinsäure aus Pyridin, in: Chem. Ber., 1882, 15, S. 62–64; DOI:10.1002/cber.188201501180.
- A. R. Gallopo, J. O. Edwards: Kinetics and mechanism of the oxidation of pyridine by Caro's acid catalyzed by ketones, in: J. Org. Chem. 1981, 46, 1684—1688; DOI:10.1021/jo00321a032.
- G. H. Burrows, L. A. King Jr.: The Free Energy Change that Accompanies Hydrogenation of Pyridine to Piperidine, in: J. Am. Chem. Soc., 1935, 57, S. 1789–1791; DOI:10.1021/ja01313a011.
- D. D. Tanner, C.-M. Yang: On the structure and mechanism of formation of the Lansbury reagent, lithium tetrakis(N-dihydropyridyl)aluminate, in: J. Org. Chem., 1993, 58, S. 1840–1846; DOI:10.1021/jo00059a041.
- A. J. De Koning, P. H. M. Budzelaar, J. Boersma, G. J. M. van der Kerk: Specific and selective reduction of aromatic nitrogen heterocycles with the bis-pyridine complexes of bis(1,4-dihydro-1-pyridyl)zinc and bis(1,4-dihydro-1-pyridyl)magnesium, in: J. Organomet. Chem., 1980, 199, S. 153–170; DOI:10.1016/S0022-328X(00)83849-8.