Оксид літію
Окси́д лі́тію — неорганічна бінарна сполука складу Li2O. Як і оксиди інших лужних металів, проявляє сильні осно́вні властивості. Являє собою білі або жовтуваті кристали. У природі знаходиться у вигляді мінералів сподумену, амблігоніту, петаліту тощо.
| Гідрид літію | |
|---|---|
 Структура Li2O |
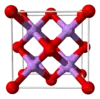 Кристалічна ґратка |
| Ідентифікатори | |
| Номер CAS | 12057-24-8 |
| Номер EINECS | 235-019-5 |
| RTECS | OJ6360000 |
| SMILES |
[Li+].[Li+].[O-2][1] |
| InChI |
InChI=1S/2Li.O/q2*+1;-2 |
| Властивості | |
| Молекулярна формула | Li2O |
| Молярна маса | 29,881 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 2,013 г/см³[2] |
| Тпл | 1570 °C[2] |
| Ткип | прибл. 2600 °C[2] |
| Розчинність (вода) | реагує |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-597,9 кДж/моль |
| Ст. ентропія S |
37,6 Дж/моль·К |
| Теплоємність, c |
54,1 Дж/моль·К |
| Пов'язані речовини | |
| Інші аніони | гідроксид літію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Застосовується у виготовленні скла з великим показником заломлення.
Знаходження у природі
Оксид літію для промисловості добувають з літієвих руд: амблігоніту, сподумену, петаліту, цинвальдиту та інших. Масова частка Li2O у них подеколи сягає 10%.
Фізичні властивості

Чистий оксид літію предсталяє собою білі кристали. Інколи він може мати жовтуватий відтінок — це спричинене наявністю домішок пероксиду літію Li2O2. Плавиться при температурі 1517 °C, його температура кипіння 2600 °C була встановлена теоретично.
Отримання
Оксид літію утворюється при горінні металевого літію:
Також він утворюється при розкладанні гідроксиду літію або його сполук з кисневмісними аніонами:
Хімічні властивості
Оксид літію взаємодіє з водою (дещо менш активно, ніж інші лужні метали):
Проявляючи осно́вні властивості, він реагує з кислотами та кислотними оксидами:
За високих температур оксид літію може взаємодіяти з активними металами та з неметалами, відновлюючись до літію:
Застосування
Оксид літію використовують для виробництва скла з великим показником заломлення. Завдяки невеликій гігроскопічності він також використовується у фотографії як проявник.
Див. також
Примітки
- Lithium oxide
- За тиску 101,3 кПа
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
