Постулати Бора
Постулати Бора — сформульовані данським фізиком Нільсом Бором основні положення будови атома, що враховують квантований характер енергії, випромінюваної електронами.
Історичні відомості
На початку 20-го століття експерименти Ернеста Резерфорда показали, що атоми складаються з розпорошеної хмари електронів, яка оточує мале позитивно заряджене ядро. Отримавши ці експериментальні дані було абсолютно природно Резерфордові розглядати планетарну модель атома (моделі Резерфорда 1911 року) з електронами, що рухаються по орбіті навколо ядра, подібного до Сонця.
Планетарна модель атома Резерфорда, багато пояснила в будові атома, але одразу після її створення виникли труднощі: ядро заряджено позитивно, а електрони — негативно. Між ними існує кулонівська сила притягання. Для того, щоб електрони не впали на ядро, вони мусять рухатись навколо нього з доцентровим прискоренням. З теорії Максвелла випливає, що якщо заряд рухається з прискоренням, то при цьому має випромінюватись електромагнітна хвиля, а розрахунки показують, що за час c електрон, рухаючись по спіралі, мусить припинити свій рух.
Дослідні ж дані показували, що за нормальних умов атом не випромінює енергію і існує як завгодно довго.
Щоб подолати цю суперечність, Нільс Бор запропонував у 1913 році свою модель, яка нині має назву «Атомна модель Бора». Він стверджував, що можливими є лише певно не дуже велика кількість станів, у яких можуть перебувати електрони. Відповідно, енергія, що вивільнюється чи поглинається, є лише результатом переходу електрона з одного стану в інший.
Формулювання
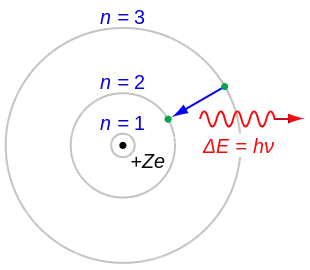
1. Атомна система може перебувати тільки в особливих стаціонарних, або квантових станах, кожному з яких відповідає певна енергія . У стаціонарному стані атом енергію не випромінює.
2. У стаціонарному стані атома електрон повинен мати дискретні (квантовані) значення моменту імпульсу. Радіуси орбіт електронів задовольняють умову:
- ,
де — маса електрона, — зведена стала Планка.
3. Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких визначають за формулою:
- ,
де і — цілі числа (номери стаціонарних станів), якщо фотон з частотою випромінюється, якщо — поглинається.
Поглинаючи світло, атом переходить із стаціонарного стану з меншою енергією в стаціонарний стан з більшою енергією. Усі стаціонарні стани, крім одного, є умовно стаціонарними. Нескінченно довго кожен атом може знаходитись лише в стаціонарному стані з мінімальним запасом енергії. Цей стан атома називається основним, всі інші — збудженими.
Формула Рідберґа
Формула Рідберґа, яка була встановлена емпірично раніше від побудови теорії Бора, нині являє собою у складі теорії Бора співвідношення, яке дає змогу обчислити величину випромінюваної електроном енергії в залежності від того, між якими за номерами енергетичними рівнями відбувається обмін електроном. У зв'язку з цим виділяють такі серії:
- серія Лаймана, що відповідає переходу електрона на першу орбіту з другої, третьої і т. д.
- серія Бальмера, коли електрони переходять на другу орбіту з третьої, четвертої і т. д.
- серія Пашена, коли переходять електрони на третю орбіту або на третій рівень з четвертої, п'ятої і т. д.
Поглинання світла — процес зворотний випромінюванню. Атом, поглинаючи світло переходить із нижчих енергетичних станів до вищих. При цьому він поглинає випромінювання з такою самою частотою, що й випромінює.
Обчислити величину випромінюваної енергії у загальному випадку, коли електрон переходить із рівня k у рівень n дає змогу формула
- ,
де . Якщо врахувати, що
- ,
для енергії фотона, то матиме місце аналогічна формула для довжини хвилі (чи частоти) випромінювання
в якій — стала Рідберґа.
Див. також
Література
- Ландау Л. Д., Лифшиц Е. М. Квантовая механика. Нерелятивистская теория // Теоретическая физика. — М.. : Физматлит, 2008. — Т. 3. — 800 с.