Радіохірургія
Радіохірургія (стереотаксична радіохірургія ; англ. stereotactic radiosurgery, SRS) — одна з методик променевої терапії (радіотерапії), яка полягає в одноразовому опроміненні патологічного вогнища високою дозою іонізуючого випромінювання.
На відміну від класичного хірургічного втручання є неінвазивною процедурою, що дає переваги в лікуванні, наприклад, глибоко розташованих злоякісних патологій головного мозку. Термін був введений Ларсом Лекселлом, одним з творців апарату Гамма-ніж, в якому використовується стереотаксична рамка для прецизійного (субміліметрового) позиціонування голови пацієнта відносно джерела іонізаційного випромінювання. Слово «стереотаксична» відноситься до тривимірної системи координат, яка забезпечує максимально точний можливий збіг віртуальної мішені, яку видно на діагностичних зображеннях пацієнта (МРТ, КТ, ПЕТ та ін.), з реальним її місце знаходженням у тілі.
Технологічні вдосконалення в галузі медичної візуалізації та обчислювальної техніки призвели до посилення клінічного застосування стереотаксичної радіохірургії і розширили її сферу діяльності. Точність локалізації і влучність, які маються на увазі при застосуванні терміну «стереотаксичний», залишаються вкрай важливими для радіохірургічних втручань. Ця точність значно збільшуються за рахунок використання пристрою, відомого як N-локалайзер. Він був винайдений американським лікарем і комп'ютерним вченим Расселом Брауном, і широко використовується в стереотаксичних хірургічних і радіохірургічних системах.
У XXI столітті початкова концепція радіохірургії розширилася, включивши в себе лікування, що складається з п'яти фракцій (сеансів променевої терапії), і стереотаксична радіохірургія була перевизначена як окрема нейрохірургічна дисципліна, яка використовує зовнішнє згенероване іонізуюче випромінювання для інактивації або знищення певних патологічних мішеней(як правило, в голові або хребті), без необхідності хірургічного розрізу. Незважаючи на подібність концепцій стереотаксичної радіохірургії та фракціонованої променевої терапії задача обох підходів принципово відрізняється, хоча, обидва методи лікування мають однакові результати при певних показаннях. На відміну від фракціанованої променевої терапії метою стереотаксичної радіохірургії є знищення тканини-мішені при збереженні сусідніх нормальних тканин, тоді як перша спирається на різну радіологічну чутливість мішені і навколишніх нормальних тканин до загальної суми накопиченої дози опромінення.
Історично, сфера використання фракціонованої променевої терапії розвивалася з оригінальної концепції стереотаксичної радіохірургії після відкриття принципів радіобіології: репарації, ресортрації, репопуляції і реоксигенації. Сьогодні обидва методи лікування доповнюють один одного, оскільки пухлини, які можуть бути стійкими до фракціанованої променевої терапії, можуть добре реагувати на радіохірургію, а пухлини, які занадто великі або занадто близько розташовані до критичних органів для забезпечення безпечності радіохірургії, можуть бути придатними кандидатами для фракціанованої променевої терапії.
Використання стереотаксичної рамки в сучасній радіохірургії не є обов'язковим: для цих цілей також можуть використовуватися системи стереоскопічної рентгенівської навігації (апарат Кіберніж, система навігації фірми BrainLab[1]), комп'ютерна томографія за допомогою конічного «пучка», яка встановлена на медичних лінійних прискорювачах в комбінації з системами контролю ІК-камерами (наприклад, продукція фірм Elekta/Medical Intelligence[2], або комбінації цих систем.
Історія розвитку

Стереотаксична радіохірургія була вперше розроблена в 1949 році шведським нейрохірургом Ларсом Лекселем для лікування невеликих патологій у мозку, для лікування яких не можна було застосувати традиційну хірургію. Він винайшов перший стереотаксичний інструмент, у якому використовувалось принцип зондування та електроди, що випромінюють рентгенівські промені. Принцип дії цього інструмента полягав у підведенні до внутрішньо-черепної мішені вузьких пучків випромінювання з декількох напрямків. Треки променів фокусуються в цільовому об'ємі і таким чином доставляють летальну кумулятивну дозу випромінювання до мішені, та обмежують дозу на сусідні здорові тканин. Завдяки вкладу фізиків Курта Лідена та Бор'є Ларссона через десять років був досягнутий значний прогрес. Тоді протонне випромінювання було замінено на рентгенівські промені. Пучок важких частинок був представлений як чудова заміна хірургічного ножа в, але синхроциклотон був занадто незграбним. Лекселл почав розробляти практичний, компактний, точний та простий інструмент, яким міг би керувати сам хірург. Це призвело до створення Гамма-ножа у 1968 році, який був встановлений в Каролінському інституті. Він складався з кількох радіоактивних джерел кобальту-60, що розміщувались у своєрідному шоломі з каналами, які фокусувалися в центрі, для опромінення гамма-променями. Цей прототип був розроблений для отримання щілинно-розділених радіаційних уражень для застосування у функціональних нейрохірургічних процедурах при лікуванні болю, рухових або поведінкових розладів, які не піддавалися традиційному лікуванню. Успіх першого прототипу спровокував створення другого пристрою, що містив 179 джерел кобальту-60. Ця друга версія Гамма-ножа була розроблена для генерації сферичних розподілів дози опромінення для лікування пухлин головного мозку та внутрішньочерепних артеріовенозних мальфармацій. У 80-ті роки в Буенос-Айресі, (Аргентина) та Шефілді (Англія) було встановлено третє і четверте покоління Гамма-ножа (з 201 джерелами кобальту-60). П'ятий Гамма-ніж був встановлений в Медичному Центрі Пітсбурзького Університету в 1987 році.

Паралельно з цими розробками аналогічний підхід був розроблений для лінійних прискорювачів частинок. Встановлення першого клінічного лінійного прискорювача з енергією 4 МеВ розпочалося в червні 1952 року. В радіотерапевтичному відділі медичних досліджень лікарні Хаммерсміт (Лондон). Систему почали використовувати для лікувати пацієнтів з 7го вересня 1953 року. Тим часом Стенфордська лабораторія мікрохвильового випромінювання розробила прискорювач з енергією 6 МеВ, який встановили в Стенфордській університетській лікарні в Каліфорнії в 1956 році. Лінійні прискорювачі такого типу швидко стали використовуватися для фракціонованої променевої терапії, але перша радіохірургія на таких апаратах стала можливою лише у 1980-му році. У 1982 році іспанський нейрохірург Дж. Барча-Салоріо почав порівнювати ефективність лікування артеріовенозних мальформацій та епілепсії на кобальтових установках з лікуванням високоенергетичними фотонами, що генерують лінійні прискорювачі. У 1984 році Бетті та Деречинський описали радіохірургічну систему на базі лінійного прискорювача. Вінстон і Лутц додатково вдосконалили технології розробки радіохірургічних втручань на основі лінійних прискорювачів шляхом включення поліпшеного стереотаксичного пристрою позиціонування та методик вимірювання точності різних компонентів. Використовуючи модифікований медичний прискорювач, першого пацієнта було проліковано у Сполучених Штатах у Бостоні у лютому 1986 року.
На сьогодні Гамма-ніж і специфіковані лінійні прискорювачі для радіохірургії доступні в усьому світі. Більшість медичних лінійних прискорювачів побудовані для звичайної фракціонованої променевої терапії та вимагають додаткових технічних рішень та знань, щоб стати спеціальними інструментами для радіохірургії. Це вдало реалізується, наприклад, системою навігації компанії BrainLab, що спеціалізується на нейрохірургії. Прикладом спеціального радіохірургічного лінійного прискорювача є Кіберніж, він компактний, встановлений на роботичній руці, яка рухається навколо пацієнта і опромінює пухлину з великого набору фіксованих позицій, тим самим імітуючи концепцію Гамма-ножа.
Клінічне застосування
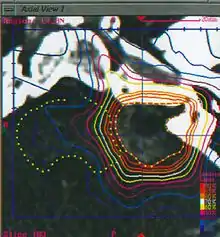
Разове опромінення високими дозами накладає певні обмеження на розмір мішені (3,0-3,5 см для пухлин і артеріовенозних мальформацій головного мозку), так як зі збільшенням розміру мішені зростає і дозове навантаження на прилеглі здорові тканини, а отже зростає ризик постпроменевих ускладнень.
Для проведення радіохірургії використовується високоточні та складні методики та обладнання, такі як медичні лінійні прискорювачі, Гамма-ніж, Кібер-ніж, тому планування лікування виконується мультидисциплінарною командою, що складається з нейрохірургів, лікарів-радіологів, променевих терапевтів та медичних фізиків. Опромінення мішеней у головному та спинному мозку планується на основі інформації з медичних зображень, що отримані шляхом комп'ютерної, магнітно-резонансної, позитрон-емісійної томографії та ангіографії.
Радіохірургія показана насамперед для терапії пухлин, судинних уражень та функціональних розладів. Для засовування цієї техніки слід проводити сувору вибірку пацієнтів на основі клінічних показань, що включають тип ураження, його місце та розмір, патологію, якщо така є, вік та загальний стан здоров'я пацієнта. Загальні протипоказання до радіохірургії включають надмірно великий розмір ураження, або занадто велика їх кількість для практичного лікування. Пацієнтам можна лікуватися амбулаторно протягом одного-п'яти днів в залежності від показаного курсу лікування. Для порівняння, середнє стаціонарне перебування у лікарні при краніотомії (звичайна нейрохірургія, що вимагає відкриття черепа) становить близько 15 днів. Результат радіохірургії часто є відстроченим у часі та може проявитися через місяці після лікування. Оскільки радіохірургія не видаляє пухлину, а інактивує її біологічно, зупинка росту ураження зазвичай вважається успішним результатом лікування.
На сьогоднішній день методи радіохірургії використовуються і поза центральної та периферичної нервової системи. Такий вид терапії називається стереотаксичною променевою терапією тіла (Stereotactic Body Radiation Therapy, SBRT) та застосовується для лікування невеликих новоутворень та метастазів в легенях, підшлунковій залозі, печінці, тощо.
Показання
Основні патології, для лікування яких показана радіохірургія:
- Метастази злоякісних новоутворень,
- Невриноми ,
- Менінгіоми ,
- Артеріовенозні мальформації,
- Каверноми ,
- Аденома гіпофіза,
- Невралгія трійчастого нерва,
- Епілепсія
- Інші пухлини, судинні патології та функціональні порушення.
Принцип дії
Основним фізичним принципом ефективності радіохірургії є вибіркова іонізація тканин високоенергетичним випромінюванням. Іонізація - це утворення іонів і вільних радикалів, які пошкоджують функціональні одиниці у клітинах. Вони можуть утворюватися з води, що знаходиться в клітині або з інших біологічних матеріалів, та здатні завдати непоправної шкоди ДНК, білкам і ліпідам. Це призводить до так званих "радіаційних мутацій" та смерті клітини. Таким чином, біологічна інактивація здійснюється в об'ємі тканини, яка опромінюється, що призводить до її руйнування. Доза опромінення зазвичай вимірюється в греях (один грей дорівнює поглиненій дозі іонізуючого випромінювання, за якої речовині масою 1 кг передається енергія іонізуючого випромінювання будь-якого виду один джоуль (1 Гр = 1 Дж/кг)). Щоб врахувати біологічний вплив на різні тканини та ступінь іонізації від різних типів джерел випромінювання застосовується величина, що називається ефективна доза (доза опромінення помножена на вагові коефіцієнти для певної тканини та певного виду випромінювання). Одиницею вимірювання ефективної дози в системі SI є зіверт (Зв).
Ризики
Радіохірургія — безболісна процедура, але деякий дискомфорт може виникнути через день або кілька після процедури через набряк тканин. Сучасні методики планування і проведення сеансів радіотерапії спрямовані на те, щоб максимально точно донести дозу опромінення до мішені та, наскільки це можливо, знизити дозу на здорові органи і тканини, але так, щоб не зашкодити ефективності лікування. Характер, тяжкість і довгостроковість побічних ефектів залежать від органів, які піддаються опроміненню, типу лікування (вид випромінювання, доза, фракціонування, паралельна хіміотерапія) та від особистісних характеристик пацієнта. Вони поділяються на ранні, що виникають під час, або одразу після процедури та проходять через певний час (почервоніння шкіри, набряк, ін.) та відстрочені — з певною імовірністю можуть виникати через місяці або роки після лікування та зберігатися усе життя (наприклад, фіброз). Променеві терапевти допомагають пацієнту подолати несприятливі побічні ефекти. Побічні реакції, що можуть виникати після проведення радіохірургії подібні до тих, що можуть виникнути після звичайної фракціанованої променевої терапії.
Види джерел випромінювання
Гамма-ніж
Гамма-ніж вважається «золотим стандартом» в радіохірургії і відповідно на нього поширюються всі її обмеження - малі розміри патологічного вогнища, відстроченность результату - та її переваги - одноразова процедура (в порівнянні з радіотерапією), відсутність хірургічних ризиків, висока ступінь конформності.
Принцип його роботи базується на використанні високоінтенсивнго випромінювання від кобальтових джерел. Зазвичай Гамма-ніж містить 201 джерело кобальту-60 з активністю приблизно 30 кюрі (1,1 ТБк), кожне з яких розміщено у захищеному напівсферичному полі. На пацієнта одягають спеціальний шолом, який хірургічно прикріплюється до черепа, так що пухлина у головному мозку лишалася нерухомою у точці фокусування гамма-променів, таким чином щоб потрібна доза випромінювання потрапляла в пухлину за один сеанс лікування, тоді як навколишні тканини головного мозку отримували найменшу можливу дозу. Кожен індивідуальний промінь має відносно низьку інтенсивність, тому випромінювання має невеликий вплив на мозкові тканини і концентрується лише на самій пухлині. Радіохірургія за допомогою Гамма-ножа є ефективною для пацієнтів з доброякісними або злоякісними пухлинами головного мозку розміром до 4 сантиметрів, патологій розвитку судин, таких як артеріовенозна мальформація, біль та інші функціональні проблеми. Для лікування невралгії трійчастого нерва ця процедура може використовуватися багаторазово. Гострі ускладнення після радіохірургії Гамма-ножом зустрічаються рідко, основні ускладнення пов'язані із загальним станом пацієнта, що лікується. У порівнянні з радіохірургією з використанням лінійних прискорювачів Гамма-ніж має трохи більшу просторову точність (понад 0,5 мм) але меншу рівномірність дози всередині мішені. Крім того, лінійні прискорювачі (на відміну від Гамма-ножа) дозволяють лікувати окрім патологій головного мозку також і патології хребта (остання модель Гамма-ножа - Perfexion дозволяє лікувати також і верхні відділи шиї). Також мінусом Гамма-ножа є зниження активності джерел з часом та висока їх вартість.
Медичні лінійні прискорювачі

Медичні лінійні прискорювачі – це найбільш важлива частина обладнання в сучасному відділенні радіотерапії. У медичних лінійних прискорювачах електрони прискорюються з використанням мікрохвиль, які створюються клістроном, тобто він представляє собою резонансний прискорювач з біжучою хвилею. Це дозволяє прискорювати електрони до більш високих енергій при менших розмірах установки, ніж при електростатичному прискоренні. Частинки створюються за допомогою електронної пушки та прискорюються в лінійному хвилеводі довжиною до 2.5 метрів. Далі пучок електронів фіксується на спеціальній мішені або для генерування рентгенівського випромінювання, або для створення пучка електронів достатнього поперечного перерізу для лікування пацієнта. Для отримання рентгенівського випромінювання, пучок електронів направляють на мішень зроблену з матеріалу, що має великий атомний номер (як правило, вольфрам) і утворюється високоенергетичне гальмівне рентгенівське випромінювання, яке після цього проходить через вирівнюючий фільтр. Далі пучку надають прямокутної форми з використанням набору з двох ортогональних коліматорів, які формують стандартне прямокутне поле в місці розташування пацієнта. Розроблено велике розмаїття модифікуючих пристроїв для лінійних прискорювачів – від конусоподібних фільтрів, та циліндричних коліматорів для стереотаксичної радіохірургії, до багатопелюсткових коліматорів, які роблять можливим більш точне налаштування форми лікувального поля для кожного окремого пацієнта. Плануються параметри поля для кожного пучка опромінювання і сеанс лікування складається з опромінення зазвичай у двох або більше лікувальних полях. На додачу до лінійного прискорювача, обладнання включає спеціальну лікувальну кушетку, яка забезпечує жорстку опору і фіксацію положення тіла пацієнтів. Лінійний прискорювач і кушетка роблять можливими обертальні рухи навколо певного центра – ізоцентра. Його просторове розташування позначається променями встановлених лазерів, які вказують на ізоцентр зліва, справа і зі стелі. Лазерна система використовується для розміщення пацієнтів в положення лікування. Пацієнт часто фіксується в цьому положенні в нерухомому стані з використанням стереотаксичної маски, яка виготовляється з пластику, що змінює форму при нагріванні, блоків фіксації або стрічок.

Станом на 2017 рік лінійні прискорювачі завдяки спеціальним коліматорам і аксесуарам здатні створювати надзвичайно вузькі промені, наприклад, від 0,15 до 0,3 мм у діаметрі. Тому вони можуть використовуватись для таких типів операцій, які до цього часу проводились відкритими або ендоскопічними методами, наприклад, при невралгії трійчастого нерва, тощо. Точний механізм ефективності при невралгії трійчастого нерва невідомий, однак використання лінійних прискорювачів для цієї мети стало дуже поширеним явищем.
Будь-який лінійний прискорювач, що оснащено конічним коліматором з вузьким отвором може генерувати вузький промінь, який може бути використаний для радіохірургії. Велике значення мають системи іммобілізації та навігації, які забезпечують точне потрапляння дози в мішень.
Кіберніж — невеликий лінійний прискорювач, що встановлений на рухомому плечі. Він має шість ступенів вільності, а отже може обертатися навколо пацієнта у всіх площинах. З моменту його створення в 1990 році було розроблено кілька поколінь безкаркасної роботизованої системи Кіберножа. Його винайшов Джон Р. Адлер, професор нейрохірургії та радіаційної онкології Стенфордського університету разом з Расселом і Пітером Шонбергами із Schonberg Research Corporation. Виготовляється компанією Accuray Icorp. (Саннівейл, США). Багато систем Кіберніж встановлені у всьому світі.
Радіохірургія на базі лінійного прискорювача Novalis Tx фірми Varian використовує вбудовану систему позиціонування ExacTrack (BrainLab), що дає можливість оцінити просторове зміщення мішені за допомогою зовнішніх інфрачервоних маркерів та стереоскопічної системи навігації, що базується на рентгенівських знімках. Спеціальна конструкція столу дозволяє підлаштовувати положення пацієнта на ньому у трьох вимірах. Коліматор прискорювача оснащеній дуже тонкими пелюстками, що дозволяє повторювати контури маленьких некомфорних утворень, закриваючи при цьому здорові тканини.
Томотерапевтична система Hi-Art - це комбінація лінійного прискорювача і КТ-сканера. Томотерапія була розроблена у 1990 році. Прискорювач генерує віялоподібний пучок. Його форма динамічно регулюється системою мультипелюсткового коліматора. Така система також може використовуватись в радіохірургії. Для іммобілізації використовують, наприклад, стереотаскичну систему Radionics, а для навігації — створені КТ-реконструкції, що порівнюють з КТ-зображеннями, на основі яких створено план лікування.
Протонна променева терапія
Протони також можуть використовуватися в радіохірургії за процедурою, яка називається протонна променева терапія (Proton Beam Therapy, PBT). Протони розганяються медичним синхротроном або циклотроном до певної енергії, що необхідна для проникнення в тканини тіла пацієнта (близько 200 МеВ), далі потрапляють у спеціальну трубку або порожнину, де за допомогою потужних магнітів формується їх траєкторія. Вони направляються до цілі лікування в організмі пацієнта. У деяких апаратах, які генерують протони лише однієї енергії між джерелом та пацієнтом поміщається спеціальна маска з пластику, яка регулює енергію променя, щоб забезпечити відповідний ступінь проникнення. Завдяки порівняно великій масі протони зазнають невеликого поперечного розсіювання в тканині, а діапазон їх довжини пробігу невеликий; пучок можна сфокусувати на пухлині, відносно не пошкоджуючи здорові тканини, що її оточують. Всі протони заданої енергії мають однакову довжину пробігу з мізерною похибкою. Більше того, практично вся їх енергія поглинається в тканині на останніх міліметрах пробігу частинок; цей максимум називають піком Брега. Тканини, розташовані за піком Брега, практично не отримують дозу. Пік Брега для протонів дає переваги протонній терапії в порівнянні з іншими формами випромінювання, оскільки більша частина енергії протона поглинається на певній відстані і не впливає на тканини, що знаходяться за межами цього діапазону. Ця властивість протонів, дозволяє створювати однорідні розподіли дози навіть для неоднорідних цілей, а також обходити радіаційно-чутливі структури, такі як оптична хіазма або стовбур мозку. Протонні медичні установки, на даний час, дуже громіздкі, дорогі та важкі для побудові в інженерному плані. Станом на 2013 рік не було жодних доказів того, що протонна терапія в більшості випадків краще, ніж будь-які інші види лікування, за винятком "кількох рідкісних педіатричних видів раку".
В Україні
Медичні заклади, що займаються радіохірургією в Україні:
- Всеукраїнський центр радіохірургії, Київ (лінійний прискорювач Varian Novalis Tx з вбудованою системою позиціонування ExacTrack);
- Кібер клікіка Спіженка, Київ (система Кібер-ніж);
- Інститут нейрохірургії імені А. П. Ромоданова НАМН України, Київ (лінійний прискорювач Varian Trilogy з конічними коліматорами).
- Томоцентр, м.Кропивницький (Tomo HD - радіотерапія)
Джерела
- McDermott, M. W. (2010). Radiosurgery. Karger Medical and Scientific Publishers. p. 196. ISBN 9783805593656.
- De Salles, A (2008). Radiosurgery from the brain to the spine: 20 years experience. Acta Neurochirurgica. Supplement. Acta Neurochirurgica Supplementum. 101. pp. 163–168. doi:10.1007/978-3-211-78205-7_28. ISBN 978-3-211-78204-0. PMID 18642653
