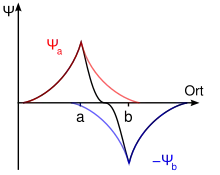
Розпушуюча молекулярна орбіталь
Розпушуюча молекулярна орбіталь — молекулярна орбіталь, що утворюється комбінацєю атомних орбіталей за теорією методу МО ЛКАО з поглинанням енергії та зменшенням величини хвильової функці, що супроводжується розпорошенням, а не концентруванням електронної густини. У теорії МО електрони описуються хвильовою функцією[1]. Коли такі хвилі знаходяться близько і в різних фазах (протифазні, знаки функцій різні), це приводить до їх комбінації (взаємодії) і нового, нестабільного щодо попередніх станів, утворення. Таким чином стабільний зв'язок не формується між цими двома атомними орбіталями[2] та як наслідок це приводить до відштовхування обох атомів. Таким чином Розпушуюча молекулярна орбіталь має протилежні властивості до Зв'язуючої молекулярної орбіталі.
Опис
За методом МО ЛКАО хвильова функція , що відповідає молекулярній орбіталі (МО), є лінійною комбінацією (сумою) функцій атомних орбіталей (АО):
- ,
або - ,
де n — кількість атомів у молекулі, , ,… — хвильові функції електронних орбіталей атомів, що взаємодіють, с — числові коефіцієнти, які визначають внесок кожної АО у МО і значення яких визначають з огляду на умову мінімуму енергії. У разі віднімання (-) , … (знаки обох функцій від'ємні), хвильова функція спадає і абсолютне значення хвильової функції у просторі між ядрами зменшується. Це означає, що при утворенні молекулярної орбіталі густина електронної хмари у між'ядерному просторі зменшується, внаслідок чого атомні ядра молекули притягуються не до між'ядерної області, а до периферії молекули, тобто ніби відштовхуються одне від одного. В даному випадку хімічний зв'язок між атомами не виникає. На такій МО електрон матиме більшу енергію, як на вихідній АО і не створюватиме зв'язку.
Диатомні молекули
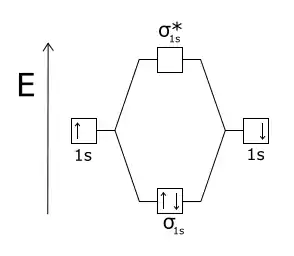 Енергетична діаграма утворення молекули дигідрогену. Молекула дигідрогену H2 - стабільна, оскільки розпушуюча молекулярна орбіталь σ*1s незаповнена, а зв'язуюча МО σзв1s заповнена електронами з утворенням ковалентного зв'язку
Енергетична діаграма утворення молекули дигідрогену. Молекула дигідрогену H2 - стабільна, оскільки розпушуюча молекулярна орбіталь σ*1s незаповнена, а зв'язуюча МО σзв1s заповнена електронами з утворенням ковалентного зв'язку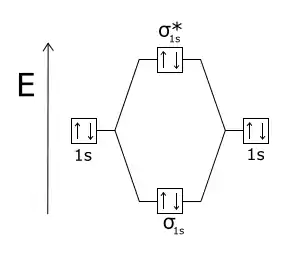 Енергетична діаграма утворення молекули гелію. Молекула гелію He2 - нестабільна, оскільки чотири електрони заповнюють зв'язуючу МО σзв1s та розпушуючу молекулярна орбіталь σ*1s, а σ*1s заважає утворенню сигма-зв'язку
Енергетична діаграма утворення молекули гелію. Молекула гелію He2 - нестабільна, оскільки чотири електрони заповнюють зв'язуючу МО σзв1s та розпушуючу молекулярна орбіталь σ*1s, а σ*1s заважає утворенню сигма-зв'язку
Примітки
- Mulliken, Robert S. (1932). Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations. Physical Review 41 (1): 49–71. doi:10.1103/physrev.41.49.
- Sannigrahi, A. B.; Kar, Tapas (1 серпня 1988). Molecular orbital theory of bond order and valency. Journal of Chemical Education 65 (8): 674. ISSN 0021-9584. doi:10.1021/ed065p674.
Джерела
В. В. Григор'єва, В. М. Самійленко, А. М. Сич. Загальна хімія. Київ. Вища школа. 1991. ст. 87-89. ISBN 5-11-003667-5