Молекулярна орбіталь
Молекулярна орбіталь — наближена хвильова функція електронів молекули, утворена суперпозицією атомних орбіталей різних атомів.
Загальна характеристика
Електронний стан, який описується молекулярною орбіталлю, делокалізований у межах усієї молекули.
Зазвичай хвильова функція молекули шукається у вигляді детермінанта Слейтера, утвореного із молекулярних орбіталей із невідомими коефіцієнтами. Коефіцієнти знаходяться із розв'язку рівняння Шредінгера одним із методів квантової механіки, наприклад, варіаційним методом, одним з яких є метод Гартрі — Фока.
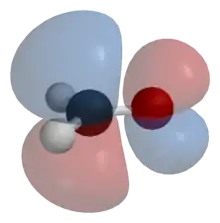
Одноелектронна хвильова функція, що описує рух електрона в ефективному полі ядер та інших електронів молекули як цілого. Така орбіталь звичайно простягається на всю молекулу або на багато атомів у молекулі і представляється як комбінація атомних орбіталей. Графічно дається у вигляді контурної діаграми, на якій хвильова функція має певне значення, чи вказується область простору, де фіксована висока (вибрана довільно, наприклад, 95 %) ймовірність знаходження електрона, що займає цю орбіталь, з наведенням знаку (+ чи –) хвильової функції в кожній частині цієї області.
Вища ЗМО та нижча ВМО
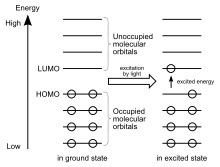
В основному стані молекули її електрони заповнюють усі орбіталі з найменшими енергіями. Та орбіталь, яка серед заповнених в основному стані має найбільшу енергію, зазвичай в літературі позначається абревіатурою ВЗМО (вища зайнята молекулярна орбіталь) або частіше англійською абревіатурою HOMO (highest occupied molecular orbital — найвища заповнена молекулярна орбіталь).
Наступна за енергією орбіталь називається НВМО (найнижча вакантна молекулярна орбіталь) або LUMO (lowest unoccupied molecular orbital — найнижча незаповнена молекулярна орбіталь). НВМО — повністю чи частково вакантна молекулярна орбіталь, що має найнижчу енергію з усіх незаселених орбіталей хімічної частинки. Її енергія отримується при розрахунках методом молекулярних орбіталей і представляє спорідненість до електрона даної молекулярної частинки, а також може характеризувати реактивність такої частинки як електрофілу.
Локалізована молекулярна орбіталь — молекулярна орбіталь, що простягається не на всю молекулу, а лише на певний її фрагмент, та є просторово виділеною з-поміж інших орбіталей, наприклад, молекулярна орбіталь типу σ, що наближено описує C–H зв'язок у метані.
Однозаселена молекулярна орбіталь (ОЗМО)
- 1. Заселена одним електроном вища зайнята молекулярна орбіталь радикала.
- 2. У загальному випадку — будь-яка молекулярна орбіталь, на якій є один електрон.
Антизв'язуюча орбiталь
Молекулярна орбiталь, яка є комбiнацiєю атомних орбiталей, і має енергiю, вищу за енергiї атомних орбiталей, що входять до її складу. Наявність на ній електронів послаблює хімiчнi зв'язки. Вона може бути описана як наслідок такої взаємодії атомних орбіталей на зв'язуваних атомах, яка приводить до зменшення електронної густини в між'ядерному просторі та до дестабілізації молекулярної частинки. Для двохатомних молекул — молекулярна орбіталь, в якій електронна густина сконцентрована не в між'ядерному просторі, а поза ним. Антизв'язуючi електрони — електрони, якi займають незв'язуючi молекулярнi орбiталi, їх наявність веде до послаблення зв'язкiв.
Аналіз молекулярних орбіталей води
Для аналізу симетрії МО на основі результатів квантовохімічних розрахунків необхідно:
- визначити точкову групу молекули
- провірити, яка система координат використана у розрахунку і чи збігаються елементи симетрії з приведеними у таблиці характерів
- якщо раніше підготовлена таблиця симетризованих орбіталей, корисно нею скористуватися.
- Декартові координати дозволяють визначити структуру атомів молекули і її орієнтацію у просторі.
- Точкова група молекули .
- Напівемпіричний розрахунок виконаний у валентному наближенні, враховується вісім електронів (ne=8): шість електронів атому О і по одному електрону від двох атомів Н. Відповідно, чотири МО із шести зайняті.
| x | y | z | ||
|---|---|---|---|---|
| 1 | O | 0. | 0. | 0. |
| 2 | H | 0. | 0.76 | 0.59 |
| 3 | H | 0. | -0.76 | 0.59 |
Матриця коефіцієнтів розкраду МО по АО для молекули води, отримана півемпіричним методом РМЗ, має наступний вигляд:
| 1 | O |
|
0.878
0. 0. -0.108 |
0.
0. 0.770 0. |
0.339
0. 0. 0.826 |
0.
1.000 0. 0. |
0.336
0. 0. -0.552 |
0.
0. 0.638 0. |
| 2 | H | 1s | 0.329 | 0.451 | -0.317 | 0. | 0.539 | -0.545 |
| 3 | H | 1s | 0.329 | -0.451 | -0.317 | 0. | 0.539 | 0.545 |
Щоб визначити симетрію кожної МО, необхідно проаналізувати коефіцієнти . Так як у одну й ту ж МО не могуть входити атомні чи симетризовані орбіталі, які перетворюються по різним неприводимим представленням (НП) групи, для визначення симетрії МО достатньо розглянути лише декотрі найбільш характерні вклади:
- У молекулярну орбіталь с ненульовими коефіцієнтами входять лише повносиметричні АО: та повносиметрична комбінація з цього слідує, що МО має симетрію .
- МО має симетрію , оскільки вона побудована з АО і симетризованої орбіталі виду які перетворюються по НП .
- МО має симетрію , оскільки, як і для , вона є лінійною комбінацією орбіталей, які перетворюються по цьому НП. Тк як це вже друга МО симетрії , їй присвоюється номер 2: «» на відміну від МО .
- HOMO складається тільки з АО атома О і має симетрію .
- LUMO включає АО , цього достатньо, щоб приписати їй симетрію ; це третя повносиметрична МО.
- МО з більшим вкладом АО має симетрію .
Таким чином, згідно результатам даного розрахунку, молекула води в основному стані має електронну конфігурацію
Джерела
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
Посилання
- Szabo A., Ostlund N. S. Modern Quantum Chemistry: Introduction to Advanced Electronic Structure Theory / Attila Szabo, Neil S. Ostlund. — Mineola, N. Y. : Dover Publications, 1996. — 864 p. — ISBN 978-0486691862.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — Вид. 2-ге, перероб. і доп. — Львів : Центр Європи, 2001. — ISBN 966-7022-19-6.