Селенометіонін
Селенометіонін — амінокислота природного походження, аналог метіоніну, що містить в молекулі атом селену замість сірки. L-енантіомер селенометіоніну є головною формою зберігання селену у рослинах, а саме в бразильських горіхах, соєвих бобах, тощо.[1] Селенометіонін розпізнається трансляційною машинерією клітин in vivo, завдяки чому він випадковим чином вбудовується в білки на місці метіоніну. Селенометіонін може бути легко окиснений, завдяки чому має антиоксидантні властивості.[2]
| Селенометіонін | |
|---|---|
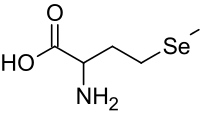 | |
| Інші назви | 2-аміно-4-метилселеніл-бутанова кислота |
| Ідентифікатори | |
| Номер CAS | 1464-42-2 |
| Номер EINECS | 215-977-0 |
| KEGG | C05335 |
| ChEBI | 27585 |
| RTECS | EK7713840 |
| SMILES |
C[Se]CCC(C(=O)O)N |
| InChI |
InChI=1S/C5H11NO2Se/c1-9-3-2-4(6)5(7)8/h4H,2-3,6H2,1H3,(H,7,8) |
| Номер Бельштейна | 1758204 |
| Властивості | |
| Молекулярна формула | C5H11NO2Se |
| Молярна маса | 196,11 г/моль |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Властивості та використання
Селен подібно до сірки належить до групи халкогенів, маючи подібні хімічні властивості. Через це, заміна одного з залишків метіоніну на селенометіонін має незначний вплив на властвості протеїнів. При цьому надмірне і надлишкове вживання селенометіоніну може мати наслідком розвиток отруєнь та хронічних хвороб (селеноз).
Селенометіонін знайшов використання в структурній та молекулярній біології для розшифровки тривимірної будови білків. Встроювання селенометіоніну в рекомбінантні білки що експресуються в бактеріях (це досягається вирощуванням бактерій на середовищі що багате на селенометіонін та бідне на метіонін) дає кристали які набагато краще розсіюють рентгенівські промені ніж білки що містять тільки природний метіонін.[3] Важкі атоми, такі як селен, допомагають вирішити так звану фазову проблему в кристалографії.[4]
Посилання
- P. D. Whanger, Selenocompounds in plants and animals and their biological significance, Journal of the American College of Nutrition, 21(3), 223—232 (2002).
- E. Block, M. Birringer, W. Jiang, T. Nakahodo, H.J. Thompson, P.J. Toscano, H. Uzar, X. Zhang, and Z. Zhu, Allium chemistry: synthesis, natural occurrence, biological activity, and chemistry of Se-alk(en)ylselenocysteines and their γ-glutamyl derivatives and oxidation products, J. Agric.
- W. A. Hendrickson, Maturation of MAD phasing for the determination of macromolecular structures, Journal of Synchrotron Radiation, 6(4), 845—851 (1999).
- A. M. Larsson, Preparation and crystallization of selenomethionine protein, IUL Biotechnology Series, 8 (Protein Crystallization), 135—154 (2009).