Теорія відштовхування електронних пар валентних оболонок (ВЕПВО)
Теорія ВЕПВО (англ. valence shell electron pair repulsion theory) — теорія відштовхування електронних пар валентних оболонок (ВЕПВО), що використовується для передбачення молекулярної структури. Основна ідея — електронні пари (зв'язуючі і вільні) валентної оболонки атома розташовуються якнайдалі одна від одної. Модель, що лежить у її основі, пояснює будову молекул, виходячи з припущення, що електронні пари розташовуються навколо атома таким чином, щоб мінімізувати електрон-електронне відштовхування.
Теорію ще називають теорією Ґілеспі—Найхолма за двома головними розробниками.
Основні положення теорії
- До валентної оболонки центрального атома A в молекулі AXn належать всі валентні електрони атома A та лише ті електрони атомів X, які беруть участь в утворенні зв'язків.
- Кожна електронна пара валентної оболонки атома A з одинарними зв'язками A–X є стереохімічно важливою, а відштовхування між ними визначає просторову будову молекули.
- В молекулах типів AX5-kEk (тут E — вільна електронна пара), див. Таблицю 2, вільна електронна пара завжди розміщується в екваторіальному положенні.
- Електрон-електронне відштовхування зменшується в ряду вільна пара — вільна пара > вільна пара — зв'язуюча пара > зв'язуюча пара — зв'язуюча пара.
- Якщо центральний атом утворює кратні зв'язки, то кратний зв'язок посідає у валентній оболонці місце одної електронної пари, а електрон-електронне відштовхування зменшується в ряду: потрійний зв'язок — одинарний зв'язок > подвійний зв'язок — одинарний зв'язок > одинарний зв'язок — одинарний зв'язок.
- Відштовхування електронних пар залежить від різниці електронегативностей атомів X та A, воно зменшується при зростанні відтягування електронної густини від центрального атома, як і при зростанні радіусу центрального атома.
Довідкові матеріали
Спираючись на загальні положення теорії, переважну більшість цих матеріалів легко відтворити власноруч. Розташування електронних пар простіше уявляти на глобусі, звідси походять терміни "аксіальний" (на полюсах) та "екваторіальний" (у площині екватора).
Таблиця 1. Просторове розташування електронних пар центрального атома А в залежності від числа електронних пар q в його валентній оболонці.
| q | Конфігурація |
|---|---|
| 2 | Лінійна |
| 3 | Рівносторонній трикутник |
| 4 | Тетраедр |
| 5 | Тригональна біпіраміда |
| 6 | Октаедр |
| 7 | Пентагональна біпіраміда |
| 8 | Квадратна антипризма |
| 9 | Трикутна призма з трьома додатковими вершинами |
| 10 | Квадратна антипризми з двома додатковими вершинами |
| 11 | Ікосаедр без однієї вершини |
| 12 | Ікосаедр |
Таблиця 2. Просторова будова молекул типу AXnEm (тут E позначає вільну електронну пару).
| Тип молекули | Конфігурація | Розташування електронних пар† | Геометрія‡ | Приклади |
|---|---|---|---|---|
| AX1En | Двоатомна | HF, O2 | ||
| AX2E0 | Лінійна | BeCl2, HgCl2, CO2 | ||
| AX2E1 | Викривлена | 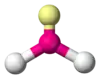 |
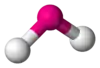 |
NO−2, SO2, O3 |
| AX2E2 | Викривлена | 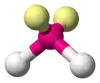 |
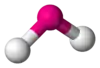 |
H2O, OF2 |
| AX2E3 | Лінійна | 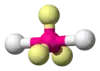 |
XeF2, I−3 | |
| AX3E0 | Правильний трикутник | 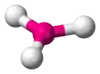 |
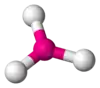 |
BF3, CO2−3, NO−3, SO3 |
| AX3E1 | Тригональна піраміда |  |
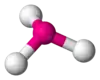 |
NH3, PCl3 |
| AX3E2 | Т-подібна | 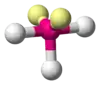 |
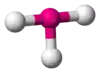 |
ClF3, BrF3 |
| AX4E0 | Тетраедр | 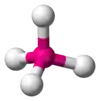 |
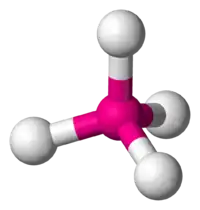 |
CH4, PO3−4, SO2−4, ClO−4 |
| AX4E1 | Дисфеноїд («Гойдалка») |  |
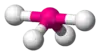 |
SF4 |
| AX4E2 | Плоскоквадратна геометрія | 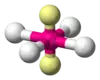 |
 |
XeF4 |
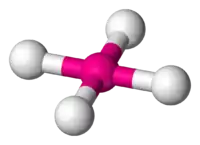
| AX5E0 | Тригональна біпіраміда | 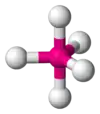 |
 |
PCl5 |
| AX5E1 | Квадратна піраміда | 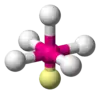 |
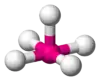 |
ClF5, BrF5 |
| AX5E2 | Плоский п'ятикутник | 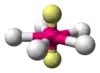 |
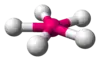 |
XeF−5, IF2−5 (вичерпний перелік) |
| AX6E0 | Октаедр | 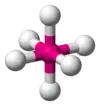 |
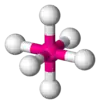 |
SF6 |
| AX6E1 | Пентагональна піраміда |  |
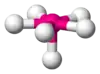 |
XeF6 |
| AX7E0 | Пентагональна біпіраміда | 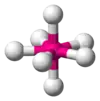 |
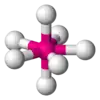 |
IF7 |
Сучасний статус теорії
У 80-ті роки XX сторіччя, зі зростанням обчислювальних потужностей, почався активний розвиток квантової теорії атомів у молекулах. Центральним об'єктом аналізу цієї теорії є електронна густина. Поміж іншим, ця теорія пропонує спосіб зіставлення кожній електронній парі певної точки простору. Виявилося, що положення таких точок, знайдених хоч із експериментальної, хоч із розрахункової електронної густини, цілком збігаються з передбаченнями теорії ВЕПВО. В такий спосіб теорія ВЕПВО отримала міцне теоретичне підґрунтя.
Література
- Р. Гиллеспи. Геометрия молекул / Пер. с англ. под ред. Ю.А.Пентина. — М.: Мир, 1975. (рос.)
- R. J. Gillespie, P. L. A. Popelier. Chemical bonding and molecular geometry from Lewis to electron densities. — New York, Oxford: Oxford University Press, 2001. — ISBN 0-19-510496-X. (англ.)
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.