Електронегативність
Електронегативність (χ) — фундаментальна хімічна властивість атома, кількісна характеристика здатності атома в молекулі відтягувати на себе електронну густину.
Загальна характеристика
Міра притягання атомом, що є складовою частиною молекули, електронів зв’язків. Це емпiричний критерiй для характеристики здатностi атома поляризувати ковалентнi зв'язки, тобто стягувати на себе електронну хмарку, пов'язаний з ефективним зарядом ядра в молекулi, що дiє на валентнi електрони. Отже зв’язки між атомами з різною електронегативністю полярні, а зв’язуючі електрони в них усереднено перебувають переважно (тобто, більше часу) біля атома з найвищою електронегативністю. Атоми в правій частині періодичної таблиці (за винятком благородних газів) є більш електронегативними, оскільки потребують менше електронів, ніж елементи зліва, для заповнення своєї зовнішньої оболонки до стабільної октетної. Вiдомi шкали електронегативностей атомiв Полінга, Маллiкена, Джафе та ін.
Електронегативність Сандерсона
У другій половині ХХ ст. Р. Сандерс[1] запропонував ідею вирівнювання електронегативності атомів при утворенні хімічного зв'язку між ними. У численних дослідженнях були знайдені залежності між електронегативністю Сандерсона і найважливішими фізико-хімічними властивостями неорганічних сполук переважної більшості елементів періодичної таблиці. Дуже плідною виявилася і модифікація методу Сандерсона, заснована на перерозподілі електронегативності між атомами молекули для органічних сполук.
Електронегативність за Маллiкеном
Електронегативність атома Х(χX), розрахована за рівнянням:
χX= (1/2) (IX+ AX)
де IX — потенціал йонізації (еВ), а AX — спорідненість до електрона атома Х(еВ) у відповідному валентному стані.
Електронегативність за Олредом— Роховим
Електронегативність атома Х(χX), розрахована (вeВ) з урахуванням ефективного заряду ядра (Zeff) за рівнянням:
χX= (3590 × Zeff/rcov2) + 0.744,
де rcov — ковалентний радіус атома Х(в пм).
Електронегативність за Полінгом
Сучасне поняття про електронегативності атомів було введено американським хіміком Лайнусом Полінгом. Полінг використовував поняття електронегативності для пояснення того факту, що енергія гетероатомного зв'язку A-B (A, B — символи будь-яких хімічних елементів) у загальному випадку більша від середнього геометричного значення гомоатомних зв'язків A-A і B-B[2].
На сьогодні для визначення електронегативності атомів існує багато різних методів, результати яких добре узгоджуються один з одним, за винятком відносно невеликих відмінностей, і в усякому разі внутрішньо несуперечливі.
Перша і широко відома шкала відносних атомів електронегативності Полінга охоплює значення від 0,7 для атомів Цезію до 4,0 для атомів Флуору. Флуор — найбільш електронегативний елемент, за ним іде Оксиген (3,5) і далі Нітроген і Хлор (3,0). Активні лужні і лужноземельні метали мають найменші значення електронегативності, що лежать в інтервалі 0,7-1,2, а галогени- найбільші значення, що знаходяться в інтервалі 4,0-2,5.
Електронегативність типових неметалів лежить у середині загального інтервалу значень і, як правило, близька до 2 або трохи перевищує 2. Електронегативність Гідрогену прийнята рівною 2,0. Для більшості перехідних металів значення електронегативності лежать в інтервалі 1,5-2,0. Близькі до 2,2 значення електронегативності важких елементів головних підгруп. Існує також кілька інших варіантів шкали електронегативності, в основу яких покладені різні властивості речовин. Але відносне розташування елементів в них приблизно однаково.
Теоретичне визначення електронегативності було запропоновано американським фізиком Робертом Маллікеном. Виходячи з очевидного положення про те, що здатність атома в молекулі притягати до себе електронний заряд залежить від енергії іонізації атома і його спорідненості до електрона, Маллікен ввів уявлення про електронегативність атома А як про середню величину енергії зв'язку зовнішніх електронів при іонізації валентних станів (наприклад, від А- до А+) І на цій основі запропонував дуже просте співвідношення для електронегативності атома:
де і — відповідно енергія іонізації атома і його спорідненість до електрона.
Строго кажучи, елементу не можна приписати постійну електронегативність. Електронегативність атома залежить від багатьох факторів, зокрема, від валентного стану атома, формального ступеня окиснення, координаційного числа, природи лігандів, що становлять оточення атома в молекулярній системі, і від деяких інших. Останнім часом дедалі частіше для характеристики електронегативності використовують так звану орбітальну електронегативність, що залежить від типу атомної орбіталі, що бере участь в утворенні зв'язку, і від її електронної заселеності, тобто від того, зайнята атомна орбіталь неподіленою електронною парою, одноразово заселена неспареними електронами або є вакантною. Але, незважаючи на відомі труднощі в інтерпретації і визначенні електронегативності, вона завжди залишається необхідною для якісного опису і прогнозування природи зв'язків в молекулярній системі, включаючи енергію зв'язку, розподіл електронного заряду і ступінь іонності, силову постійну і т. д.
У період бурхливого розвитку квантової хімії як засобу опису утворень молекул (середина і друга половина XX століття) плідним виявився підхід Полінга, який серед інших досліджень запровадив власну шкалу електронегативності, в якій із «стандартних» елементів максимальну має Флуор (), а мінімальну — цезій (). Ступінь іонності зв'язку, тобто внесок структури, при якій більш електронегативний атом повністю «забирає» собі валентні електрони, у загальну резонансну «картину», у цій теорії визначається як
де — різниця електронегативності атомів, що утворюють зв'язок.
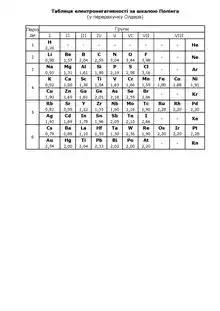
Значення електронегативності за Полінгом
| Група | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Період | |||||||||||||||||||
| 1 | H 2,20 |
He - | |||||||||||||||||
| 2 | Li 0,98 |
Be 1,57 |
B 2,04 |
C 2,55 |
N 3,04 |
O 3,5 |
F 3,98 |
Ne - | |||||||||||
| 3 | Na 0,93 |
Mg 1,31 |
Al 1,61 |
Si 1,90 |
P 2,19 |
S 2,58 |
Cl 3,16 |
Ar - | |||||||||||
| 4 | K 0,82 |
Ca 1,00 |
Sc 1,36 |
Ti 1,54 |
V 1,63 |
Cr 1,66 |
Mn 1,55 |
Fe 1,83 |
Co 1,88 |
Ni 1,91 |
Cu 1,90 |
Zn 1,65 |
Ga 1,81 |
Ge 2,01 |
As 2,18 |
Se 2,55 |
Br 2,96 |
Kr - | |
| 5 | Rb 0,82 |
Sr 0,95 |
Y 1,22 |
Zr 1,33 |
Nb 1,6 |
Mo 2,16 |
Tc 2,1 |
Ru 2,2 |
Rh 2,28 |
Pd 2,20 |
Ag 1,93 |
Cd 1,69 |
In 1,78 |
Sn 1,96 |
Sb 2,05 |
Te 2,1 |
I 2,66 |
Xe 2,60 | |
| 6 | Cs 0,79 |
Ba 0,89 |
* |
Hf 1,3 |
Ta 1,5 |
W 1,7 |
Re 1,9 |
Os 2,2 |
Ir 2,20 |
Pt 2,28 |
Au 2,54 |
Hg 1,9 |
Tl 1,8 |
Pb 1,8 |
Bi 1,9 |
Po 2,0 |
At 2,2 |
Rn - | |
| 7 | Fr 0,7 |
Ra 0,9 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Uut |
Uuq |
Uup |
Uuh |
Uus |
Uuo | |
| Лантаноїди | * |
La 1,1 |
Ce 1,12 |
Pr 1,13 |
Nd 1,14 |
Pm 1,13 |
Sm 1,17 |
Eu 1,2 |
Gd 1,2 |
Tb 1,1 |
Dy 1,22 |
Ho 1,23 |
Er 1,24 |
Tm 1,25 |
Yb 1,1 |
Lu 1,27 | |||
| Актиноїди | ** |
Ac 1,1 |
Th 1,3 |
Pa 1,5 |
U 1,38 |
Np 1,36 |
Pu 1,28 |
Am 1,13 |
Cm 1,28 |
Bk 1,3 |
Cf 1,3 |
Es 1,3 |
Fm 1,3 |
Md 1,3 |
No 1,3 |
Lr 1,291 | |||
Абсолютна електронегативність
Властивість хімічної системи (χ), що визначається за теорією функціоналу густини рівнянням:
- χ = – (δE/δN)v ≅ (I +A)/2,
де E — загальна енергія системи, v — індекс, що показує якого ядра стосується дана величина, N — число електронів в хімічній частинці, I та A є відповідно потенціалом іонізації та спорідненістю до електрона хімічної частинки в основному стані (відрізняється від співвідношення Маллікена, де I та A відносяться до атома з конкретною електронною конфігурацією). Може бути характеристикою реактивності хімічної частинки, а також служити мірою полярності зв’язку.
Примітки
- Sanderson, R. T. 1983 Electronegativity and bond energy,Journal of the American Chemical Society,1983, V. 105, p — 2259,
- IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.E01990
Посилання
Джерела
- L. Pauling: The nature of the chemical bond and the structure of molecules and crystals. Mei Ya Publications Taipei, 1960. (англ.)
- Hans R. Christen; Gerd Meyer: Grundlagen der allgemeinen und anorganischen Chemie. Sauerländer, Frankfurt am Main 1997. ISBN 3-7941-3984-4 (нім.)
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л.М.Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0