Титанат барію
Титана́т ба́рію — неорганічна хімічна сполука з формулою BaTiO3, сегнетоелектрик. Монокристали титанату барію прозорі, а порошок — білого кольору. Сегнетоелектичні властивості титанату барію відкрив 1944 року уродженець Білої Церкви — Вул Бенціон Мойсейович.
| Barium titanate | |
|---|---|
 Кераміка титанату барію в пластиковій упаковці | |
| Ідентифікатори | |
| Номер CAS | 12047-27-7 |
| PubChem | 6101006 |
| Номер EINECS | 234-975-0 |
| RTECS | XR1437333 |
| SMILES |
[Ba+2].[Ba+2].[O-][Ti]([O-])([O-])[O-] |
| InChI |
1/2Ba.4O.Ti/q2*+2;4*-1;/r2Ba.O4Ti/c;;1-5(2,3)4/q2*+2;-4 |
| Властивості | |
| Молекулярна формула | BaTiO3 |
| Молярна маса | 233,192 г/моль |
| Зовнішній вигляд | білі кристали |
| Запах | без запаху |
| Густина | 6,02 г/см3, твердий |
| Тпл | 1625 °C |
| Розчинність (вода) | нерозчинний |
| Розчинність | невелика розчинність у розведених мінеральних кислотах; розчиняється у концентрованій сірчаній кислоті та плавиковій кислоті |
| Структура | |
| Кристалічна структура | тетрагональна, tP5 |
| P4mm, No. 99 | |
| Небезпеки | |
| R-фрази | Шаблон:R20/22 |
| S-фрази | S28A, S37 та S45 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Структура
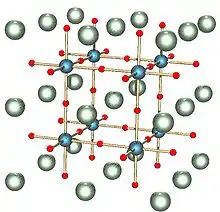
Титанат барію має п'ять термодинамічних фаз, у залежності від температури: гексагональну, кубічну, тетрагональну, орторомбічну й тригональну. Усі фази, крім кубічної, мають сегнетоелектричні властивості. Високотемпературна кубічна фаза найпростіша: вона складається з октаедричних центрів TiO6, що визначають куб, у вершинах якого перебуває Ti, а ребра мають вигляд Ti-O-Ti. Ba2+ розташовані в центрах куба і мають номінальне координаційне число 12. При нижчих температурах титанат барію переходить у фази з нижчою симетрією, при цьому Ba2+ зміщується із центра комірки. Саме ці зміщення й визначають незвичайні властивості речовини.
Отримання
Титанат барію можна отримати, нагріваючи карбонат барію разом із двоокисом титану. Реакція відбувається через спікання в рідкій фазі. Монокристали вирощують при температурі 1100 °C із розплаву флуориду калію[1]. Для легування додають домішки. Наприклад, таким чином отримують твердий розчин із титанатом стронцію. Розплав реагує з трихлоридом азоту з утворенням зеленої або сірої суміші, яка все ще зберігає сегнетоелектричні властивості.
Застосування
Як діелектрик із високою діелектричною проникністю титанат барію використовують у конденсаторах, а також у мікрофонах та інших перетворювачах. Спонтанна поляризація титанату барію становить при кімнатній температурі приблизно 0,15 Кл/м2. Точка Кюрі — 120 °C[2]. Як п'єзоелектрик його замінив цирконат титанат свинцю, відомий як PZT. Полікристалічний титанат барію має додатній температурний коефіцієнт, що робить його придатним для термісторів та електричних обігрівачів з терморегулюванням.
Ще одна галузь застосування титанату барію — нелінійна оптика. Він може використовуватися у видимій та близькій ультрафіолетовій області спектру. В ньому сильне зв'язування хвиль, що дозволяє використовувати його для чотирихвильового змішування. Для підвищення фоторефракції його легують іншими елементами, наприклад, залізом[3].
Тонкі плівки титанату барію мають властивості електрооптичної модуляції на частотах понад 40 ГГц[4].
Див. також
Виноски
- Francis S. Galasso «Barium Titanate, BaTiO3» Inorganic Syntheses 1973, Volume 14, 142—143. DOI:10.1002/9780470132456.ch28.
- Wadhawan, Vinod K. (2000). Introduction to ferroic materials. CRC Press. с. 10. с. 740. ISBN 978-90-5699-286-6.
- Fe:LiNbO3 Crystal. Архів оригіналу за 22 липня 2013. Процитовано 6 червня 2009.
- Tang, Pingsheng; Towner, D; Hamano, T; Meier, A; Wessels, B (2004). Electrooptic modulation up to 40 GHz in a barium titanate thin film waveguide modulator. Optics Express 12 (24): 5962–7. PMID 19488237. doi:10.1364/OPEX.12.005962.